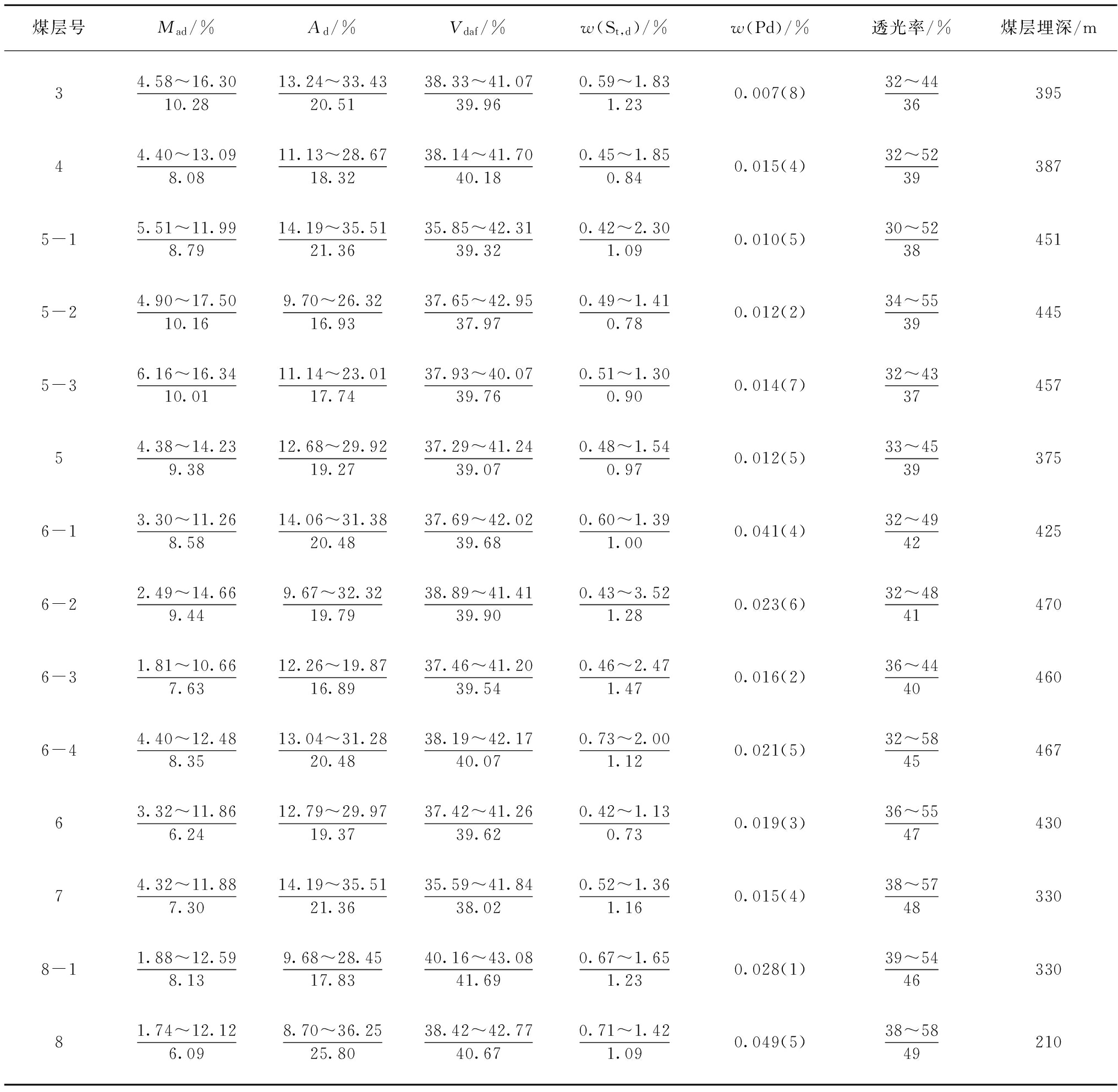
固-液相变二氧化碳吸收剂的研究进展
0 引 言
全球气候变暖已成为当今世界最突出的环境问题之一。普遍认为大量人为CO2排放是导致全球变暖的主要因素。CO2排放主要来源于火力发电过程中的煤炭燃烧。因此,减少火力发电厂烟气的CO2排放对于缓解全球变暖问题至关重要。碳捕集、利用和封存(CCUS)是减少CO2排放的关键技术,可为实现碳中和提供重要技术支撑。碳捕集可分为燃烧前、燃烧中、燃烧后捕集[1]。燃烧后CO2捕集无需对现有电厂进行大规模改造,只需增加碳捕集设备即可,是国内外研究重点。
基于有机胺的化学吸收法具有CO2吸收迅速、选择性好等特点[2-3],在燃烧后CO2捕集领域已有一定的工业化应用。但传统有机胺吸收法捕集CO2时吸收剂的再生能耗高达3.7~4.0 GJ/t(以CO2计,下同),过高的再生能耗可导致电厂发电成本增加70%~100%[4-5]。为降低CO2捕集能耗,相变吸收剂应运而生。该类吸收剂吸收CO2后能形成互不相溶的两相,CO2主要富集于其中一相,因此仅需将CO2富相送至再生塔解吸,可大幅减少吸收剂的再生体积,进而可将再生能耗降至1.8~2.5 GJ/t[6-8]。相变吸收剂根据相变形态的不同可分为液-液相变吸收剂和固-液相变吸收剂[9-10]。相比于液-液相变吸收剂,固-液相变吸收剂具有CO2吸收速率快、产物易分离等特点[11-12]。
近年来,研究者对新型固-液相变吸收剂开展了大量研究。笔者将从传统有机胺法和相变吸收法捕集CO2工艺出发,对比不同工艺的特点,重点阐述固-液相变吸收剂及其捕集CO2的研究现状。
1 化学吸收法捕集CO2工艺
1.1 传统有机胺捕集CO2工艺
图1为传统有机胺法捕集CO2工艺流程。由图1可知,经脱硝脱硫后的烟气(40~60 ℃,CO2体积分数在10%~15%)从吸收塔底部进入,吸收剂从吸收塔顶部喷淋而下,烟气与吸收剂充分接触。吸收剂中的有机胺选择性地与烟气中的CO2反应并生成可溶性且不稳定的盐,吸收后的净化气体从塔顶排出。CO2富液经热交换器加热后送入再生塔进行CO2解吸,解吸温度约120 ℃。不稳定的盐分解释放出CO2后,所得贫液通过热交换器降温进入吸收塔顶部循环使用。解吸的高浓度CO2经干燥、压缩后可用于商业应用或地质封存。通常,有机胺吸收剂为胺的水溶液,胺质量分数约30%,水约占70%。由于水的比热容大且沸点较低,CO2解吸时吸收剂在溶剂水的加热汽化过程消耗大量能量,导致再生能耗较高[13-14],且胺的水溶液在实际工艺应用中易造成设备腐蚀,因而传统有机胺吸收剂的推广受到限制。

图1 传统有机胺法捕集CO2工艺流程
Fig.1 Process of CO2 capture by traditional organic amine method
1.2 液-液相变吸收剂捕集CO2工艺
液-液相变吸收剂作为一种新型吸收剂,具有显著的节能潜力,受到广泛关注。该类吸收剂在吸收CO2前为均相溶液,吸收CO2后形成互不相溶的液-液两相,CO2主要富集在其中一相,此相称为CO2富相,另一相为CO2贫相。通过相分离,只需将CO2富相送至解吸塔再生,CO2贫相则直接进入吸收塔与解吸CO2后的富相(此时为再生贫相)混合循环利用,该工艺将大幅减少吸收剂的再生液量,进而达到降低再生能耗的目的。液-液相变吸收剂被认为是较理想的CO2化学吸收剂[15],其捕集CO2的工艺流程如图2所示。与传统有机胺吸收法捕集CO2工艺相比,液-液相变吸收剂捕集CO2工艺主要增加了相分离步骤。

图2 液-液相变吸收剂捕集CO2工艺流程[16]
Fig.2 Process of CO2 capture by liquid-liquid phase change absorbents[16]
液-液相变吸收剂虽然减少进入解吸塔的再生体积进而有效降低再生能耗,但吸收剂吸收CO2后富液黏度将大幅上升,易造成液-液分离不便,导致输送成本增加[17-18],这些问题还需通过进一步研究加以解决。
1.3 固-液相变吸收剂捕集CO2工艺
近年来,越来越多的研究致力于固-液相变吸收剂的研发。与液-液相变吸收剂相比,固-液相变吸收剂在吸收CO2前呈均相,与CO2的反应产物能以固体的形式从液相主体中析出,固-液两相的分离较液-液分离更方便。吸收饱和后的固体产物通常为氨基甲酸盐或碳酸氢盐,液体为相应吸收体系中的溶剂。通过固-液两相分离,再生时只需对固相进行解吸,可大幅减少吸收剂的再生体积,进而降低再生能耗[11,19]。CO2解吸后,固相可转变为液相,可与此前分离的CO2贫液混合,重新进入吸收塔循环使用。固-液相变吸收剂捕集CO2工艺流程如图3所示。

图3 固-液相变吸收剂捕集CO2工艺流程[20]
Fig.3 Process of CO2 capture by solid-liquid phase change absorbents[20]
综上所述,传统有机胺法吸收CO2具有溶剂稳定、工艺简单等优点,但较大的再生体积所导致的高再生能耗限制了其工业推广和应用。相变吸收剂在吸收CO2后形成互不相溶的两相,CO2主要富集于其中一相,因此仅需将CO2富相送至再生塔解吸,可大幅减少吸收剂的再生体积,进而降低再生能耗。相比于液-液相变吸收剂,固-液相变吸收剂的CO2吸收产物能以固体的形式从溶液中沉淀出来,可实现快速分离,且在吸收过程中,吸收平衡可向产物生成的方向移动,有利于获得较高的CO2吸收速率和吸收容量。鉴于固-液相变吸收剂的优点,其成为近年来新型CO2吸收剂的研究热点。以下对近几年国内外研究的不同类型的固-液相变吸收剂进行分类评述,并对具有代表性的固-液相变吸收剂进行介绍。
2 固-液相变吸收剂捕集CO2
固-液相变吸收剂在吸收CO2后产物形成固-液两相,CO2主要富集在固相中,再生环节只需对固相进行解吸再生,液相为CO2贫相可直接进入吸收塔循环使用。目前,固-液相变吸收剂主要包括有机胺非水溶液、氨基酸盐或碳酸盐溶液、离子液体溶液等。
2.1 有机胺非水溶液固-液相变吸收剂
有机胺非水溶液固-液相变吸收剂以有机胺作为吸收活性组分,有机试剂作为溶剂。该类吸收剂具有腐蚀性小、反应速率快、再生性能好的优点。构建固-液相变吸收剂,关键在于有机胺和溶剂的筛选。ZHENG等[21]考察了不同有机胺和醇类溶剂的组合,发现不同有机胺/醇体系吸收CO2后可形成胶状或颗粒粉末状产物。其中,TETA/乙醇溶液在吸收CO2后具有良好的固-液相变效果,固体产物为粉末状沉淀(图4)。经分析,固相富含的CO2占总CO2吸收量的81.8%。此外,与TETA/H2O溶液相比,TETA/乙醇溶液具有较高的CO2吸收速率和吸收容量,且反应产物在较低温度下即可分解释放CO2。TAO等[22]研究了乙二胺(EDA)/乙醇和哌嗪(PZ)/乙醇溶液的吸收CO2性能。发现2种吸收剂吸收CO2后均会出现固体沉淀。通过热力学分析,证实2种吸收剂的再生热均比传统MEA溶液低。此外,对比EDA/乙醇和EDA/H2O的CO2吸收情况,发现以乙醇作为溶剂时,EDA的CO2吸收负荷是其在水体系中的2倍。但醇类溶剂通常蒸气压高、沸点低,在使用过程中易挥发损失。

图4 TETA/乙醇溶液[21]
Fig.4 TETA/ethanol solution[21]
为克服醇类溶剂易挥发损失的缺点,研究者尝试使用一些沸点高且不易挥发的聚合物做溶剂,如聚乙二醇(PEG200)。陶梦娜[23]选取PEG200作为溶剂,构建TETA/PEG200固-液相变吸收体系用于烟气中CO2捕集,发现TETA/PEG200具有良好的固-液相变特性,其在60 ℃下吸收CO2至饱和后,固体产物富集约92%的CO2。此外,还使用一种新型微波加热再生法用于固相产物的分解。微波加热条件下,经过4次循环吸收/解吸,吸收剂再生效率仍然高达96%[24]。李誉[25]针对微波加热法解吸CO2固相产物进行研究。研究表明,微波加热比传导加热方式更均匀且速度快,具有选择性加热和操作反应迅速的优点。高金哲[26]对微波加热条件下一系列TETA非水吸收剂的再生性能进行研究,并与传导加热再生方式对比,结果发现使用微波加热对再生速率、再生容量、再生能耗等都有明显优势,其中,TETA/BDO和TETA/PEG200吸收剂的CO2回收率分别提高2.6和2.7倍,再生能耗则分别下降69%和76%。
除醇类聚合物,醚类、酮类和酯类有机溶剂也可用于构建固-液相变体系。ZHANG等[27]选用二乙烯三胺(DETA)作为吸收促进剂,以乙醇、二甘醇二甲醚(DEGDME)、N-甲基吡咯烷酮(NMP)和碳酸二甲酯(DMC)作为溶剂,研究4种溶剂的固-液相变行为。研究发现,不同有机溶剂对固相沉淀的形成没有影响,产物均为相应的氨基甲酸盐。在微波加热条件下,几种吸收剂均有较稳定的再生性能。ZHAO等[28]研究了EDA、DETA、TETA、四乙烯五胺(TEPA)、PZ和三亚乙基二胺(DABCO)等多元胺在醚类和酯类等有机溶剂中吸收CO2的相变行为。结果表明,除DABCO外,所研究的几种多元胺与CO2反应均能生成固相沉淀。DABCO/有机溶剂吸收CO2不能生成固相的原因在于DABCO为叔胺,N原子上没有可转移的质子,无法与CO2反应生成氨基甲酸盐。此外,ZHAO等[28]通过油浴加热解吸发现DETA与CO2的反应产物最易分解,而PZ与CO2的产物分解较困难且产物的分解温度与PZ的沸点接近,导致固相产物的分解会引起吸收剂的挥发损失。LI等[29]利用N, N-二甲基甲酰胺(DMF)作溶剂,开发了PZ/DMF固-液相变吸收剂,该吸收剂的CO2吸收容量和最大吸收速率比PZ/H2O溶液高22.9%和29.0%。此外,电化学试验表明,PZ/DMF的腐蚀性显著低于PZ/H2O溶液。为研究不同溶剂对固相产物晶型的影响,LI等[30]将EDA分别溶于DMF和N, N-二甲基乙酰胺(DMA)中用于CO2吸收。结果表明,EDA与CO2的反应产物在2种溶剂中的分子结构相同但排列方式存在差异,以DMA作为溶剂其吸收产物呈正交晶型,而以DMF作为溶剂其产物呈单斜晶型(图5)。前者的再生热低于后者,这是由于单斜晶型向正交晶型转变为吸热过程。

图5 分子和晶体结构[30]
Fig.5 Molecular and crystal structures[30]
由于基于PZ的固-液相变吸收剂吸收CO2产物解吸较困难,为提高该类吸收剂的再生性能,CHEN等[19]构建一种三元固-液相变吸收剂(2-氨基-2-甲基-1-丙醇(AMP)/PZ/二丙二醇二甲醚(DME))用于CO2捕集。结果表明,AMP/PZ/DME固相的CO2体积分数占总吸收量94%,但体积仅占总体积43%,经历4次循环吸收,再生效率仍高达82%,吸收剂的再生能耗仅为1.61 GJ/t,较传统MEA水溶液低57%。
除性能考察,研究者也对有机胺非水溶液吸收CO2的反应机理和固-液相变机理进行初步分析。目前,大部分研究表明,有机胺非水固-液相变吸收剂主要通过两性离子机理吸收CO2,即胺分子首先与CO2反应生成两性离子,随后两性离子与另一胺分子进行分子间质子转移,生成氨基甲酸盐和质子化胺(图6)。对于固-液相变机理,ZHANG等[27]通过分子模拟,认为固-液相变现象的发生是由胺分子在CO2吸收前后的极性转变所致,即在有机溶剂中,胺与CO2反应生成极性的氨基甲酸盐,该产物的极性比胺和溶剂分子的极性大,因此导致其在溶剂中析出。TAO等[31]认为两性离子型单氨基甲酸酯(ZM)在形成沉淀中起重要作用,通过分子动力学模拟,进一步证实ZM物质间极易形成分子内和分子间氢键,导致聚集产生沉淀。CHEN等[19]根据NMR、XRD表征手段及量子化学计算结果,发现氨基甲酸盐产物能通过氢键作用发生自聚并具有较高的晶格能,导致其在有机溶剂中的溶解度较低,进而形成不溶的固相白色晶体颗粒。GAO等[32]通过浊度和颗粒尺寸测定,认为固相产生的原因是反应生成的小颗粒通过自聚作用形成大颗粒。

图6 AMP/PZ/DME捕集CO2反应机理[19]
Fig.6 Mechanism of CO2 capture into the AMP/PZ/DME biphasic solvent[19]
目前,有机胺非水固-液相变吸收体系在一定程度上解决了传统有机胺水溶液吸收剂腐蚀性大及再生能耗高的缺点,也改善了有机溶剂易挥发的问题。同时,研究者们也初步揭示有机胺固-液相变吸收剂捕集CO2的反应机理及固-液相变机制。但固-液相变吸收体系的构建规律还未明确,且有些吸收体系存在固相产物易形成黏稠胶状物及再生困难的问题,这些问题还有待进一步深入研究。
2.2 盐类固-液相变吸收剂
盐类固-液相变吸收剂主要有氨基酸盐的水溶液和贫水溶液以及碳酸盐水溶液。
氨基酸盐具有与有机胺相同的氨基官能团,并且其毒性低、挥发性小、热稳定性好、反应活性高[33]。近年来,基于氨基酸盐的固-液相变吸收剂的开发受到重视。FERNANDEZ等[20]研究了一种基于牛磺酸钾水溶液固-液相变吸收CO2的新工艺,该工艺与传统MEA工艺相比可将再生能耗降低35%,再沸器能耗能从3.7 GJ/t降低到2.4 GJ/t。KUMAR等[34]以牛磺酸溶液为例,研究氨基酸盐水溶液吸收CO2的结晶现象,发现CO2吸收负荷与初始氨基酸盐浓度呈反比,产物结晶会降低CO2吸收速率,其原因是结晶的存在阻碍了气液的有效传质。WANG等[35]通过筛选多种氨基酸盐,确定了一种独特的相变氨基酸盐溶液(Ala-NaOH-CO2-H2O)。该溶液在CO2吸收过程中能形成CO2富相(固相)和CO2贫相(液相),被吸收的CO2大部分富集在富相中(图7)。富相中的产物主要为碳酸氢盐,具有良好的再生性能。SHEN等[36]将脯氨酸钾(ProK)溶于乙醇制备了一种新型非水吸收剂用于CO2的吸收-解吸。研究发现,ProK/乙醇吸收剂的CO2吸收速率显著高于基于水体系的ProK溶液,且吸收CO2后能发生固-液分相,55%~60%的CO2富集在固相中。XRD和NMR表征显示,固相产物主要为脯氨酸氨基甲酸盐、碳酸氢盐和烷基碳酸盐[37]。再生结果显示,1 mol/L ProK溶液的CO2循环容量可达0.5 mol/kg(以溶液计),表明吸收剂具有良好的再生性能。此外,甘氨酸钾(GlyK)[38]、β-丙氨酸钾(AlaK)[39]溶液在离子浓度较高时吸收CO2也会发生固-液相变现象。

图7 Ala-NaOH-CO2-H2O溶液吸收CO2示意及相变后情况[35]
Fig.7 Scheme of CO2 capture by the Ala-NaOH-CO2-H2O solution and the solution photograph after phase change[35]
由于水对CO2产物具有较好的溶解性,氨基酸盐水溶液吸收的CO2仍有相当一部分不能以固相形式析出。针对此现象,研究者提出用有机溶剂代替部分水开发贫水氨基酸盐固-液相变吸收剂,以期改善吸收剂的分相性能。如BIAN等[40]构建了ProK/H2O/乙醇三元体系,该体系捕集CO2具有良好的分相效果。此外,对吸收速率、吸附热及固体再生等性能进行考察,研究表明,相比于MEA水溶液,ProK/H2O/乙醇体系的CO2溶解度及吸收速率较高,是一种颇具节能潜力的CO2吸收剂,但乙醇挥发性高的问题有待解决。ALIVAND等[41]使用甘氨酸钾(GlyK)、水和二甲基甲酰胺(DMF)组成相变溶剂,该相变溶剂较基于水的GlyK溶剂CO2吸收负荷提高26.1%,热负荷降低59.1%。LI等[42-43]以ProK和肌氨酸钾(SarK)作为活性成分,少量水作为溶剂,2-烷氧基乙醇用作物理抗溶剂,开发贫水氨基酸盐吸收剂用于CO2吸收。研究表明,使用弱极性溶剂有利于系统中固体沉淀的形成。随后,进一步研究2种贫水氨基酸盐溶液在不同条件下的物理化学特性,包括溶液密度、黏度和CO2溶解度,为吸收剂捕集CO2的热力学模型的建立提供基础数据[44]。OLYAEI等[45]基于GlyK,分别利用乙二醇单乙醚(2EE)、NMP和DMF代替部分水构建了3种贫水固-液相变吸收剂,并考察其捕集CO2的性能。结果表明,增加有机溶剂可以显著改善吸收剂的相变特性,产物可有效从溶液主体中析出。这主要是因为在有水参与的情况下,GlyK与CO2反应最终生成碳酸氢盐,碳酸氢盐在有机溶剂中的溶解度较小,进而以沉淀析出(图8)。

图8 GlyK贫水溶液相变吸收CO2的反应过程[45]
Fig.8 Proposed pathway for CO2 absorption using GlyK phase change absorbent[45]
通过加入物理抗溶剂在一定程度上能降低反应产物在溶液中的溶解度,但通过溶解度的变化来实现固-液相分离存在相分离效率较低,且受吸收剂浓度影响较大的问题。为提高固-液相分离效率、简化相分离操作,欧阳煌[46]使用苄乙基三甲基氯化铵(VBTAC)和N-异丙基丙烯酰胺(NIPAM)制备了分子量可控的甘氨酸型温敏性相分离吸收剂PVB(5K)-Gly-b-PNIP(2K),并研究浓度及温度对吸收剂的CO2吸收能力和相分离效率的影响。研究表明,吸收剂在0.4 mol/L下吸收负荷最高,可达1.11 mol/mol;在高于相变温度下离心,相分离效率显著提高,浓度为0.7 mol/L时相分离效率可达16.7%。此外,还使用甘氨酸(Gly)、天冬氨酸(Asp)、色氨酸(Trp)、L-组氨酸(His)为阴离子制备了不同氨基酸型的吸收剂PVB(2.5K)-AA-b-PNIP(1K),考察氨基酸类型对吸收剂吸收能力和相分离性能的影响。研究发现,氨基酸类型为Trp且吸收剂浓度为1.2 mol/L时的分相性能最佳。
关于节能潜力,ARONU等[47]对比了氨基酸盐固-液相变吸收剂与无相变能力的氨基酸盐体系,研究表明有相变能力的氨基酸盐吸收剂所需的能耗相较于吸收后未能分相的吸收剂显著降低。另外,其研究的新型C沉淀体系具有较高的吸收速率,循环负荷比质量分数30%的MEA高61%。
碳酸盐也可用于开发固-液相变吸收剂,其具有低毒、热稳定性好、反应焓小和成本低等优势。碳酸盐溶液吸收CO2的固-液相变原理为碳酸盐与CO2反应生成溶解度较低的碳酸氢盐固体沉淀,碳酸氢盐再生成碳酸盐溶液再次用于吸收,因而仅需对沉淀进行再生,从而可降低吸收剂的再生能耗。墨尔本大学的研究机构将高浓度K2CO3体系应用于燃烧后CO2捕集,提出基于K2CO3溶液的沉淀工艺——UNO MK3,该系统的CO2处理量可达1 t/d[48]。K2CO3吸收CO2后转变为KHCO3,溶液经冷却降温可使KHCO3沉淀析出。然后进行固液分离,KHCO3固体在高温下分解释放出CO2,生成的碳酸钾可循环使用。UNO MK3工艺减少了再生过程的水分汽化量,再生能耗从传统无沉淀工艺的3.0 GJ/t降低到约2.5 GJ/t[49]。ZHANG等[50]为降低解吸能耗,使用浓缩后的碳酸钾/碳酸氢钾(PCB)水溶液作为吸收剂,吸收剂在吸收CO2后发生固-液相变行为,并研究不同压力、温度和CO2负荷下的解吸能耗。研究结果表明,在高温高CO2负荷条件下解吸能有效降低能耗,与传统5 mol/L MEA溶液相比,PCB系统解吸能耗仅为前者的1/3。RAKSAJATI等[51]用活化的K2CO3溶液捕集CO2,通过优化捕集工艺后对再生能耗和工艺运行成本进行评估。研究结果表明,由于固相产物再生显热低且水的汽化消耗热量少,相比于传统MEA溶液,基于K2CO3的固-液相变吸收剂的再生能耗降低,可节省CO2捕集成本40%。
盐类固-液相变吸收剂具有绿色、成本低、原料易得的优点,应用潜力良好。但现有盐类相变吸收剂的固-液相变特性及相分离效率仍有待进一步改善,同时研究缺乏对反应机理方面的深层讨论,此方面空缺还有待完善、填补。
2.3 基于离子液体的固-液相变吸收剂
离子液体具有热稳定性高、不易挥发的性质,被视为“绿色溶剂”。因此,基于离子液构建绿色稳定的固-液相变吸收剂具有一定研究价值[52-53]。目前,离子液固-液相变吸收剂主要有2种类型:① 离子液体作为溶剂,有机胺作为活性组分;② 离子液作为活性组分,其他有机试剂作溶剂。对于前者,离子液通常为不含氨基基团的常规离子液,而后者的离子液为含氨基基团的功能化离子液。
CAMPER等[54]以一种常规咪唑型室温离子液和MEA混合构建复合吸收剂用于CO2捕集,发现物质的量分数50%的MEA在离子液中可以与CO2快速反应生成MEA-氨基甲酸盐沉淀(图9),且沉淀物的形成促进了吸收反应的进行。使用DEA与离子液体组合,吸收剂捕集CO2后同样能产生相应的固态氨基甲酸盐产物。相比于水相有机胺吸收剂,离子液/有机胺固-液相变吸收体系能够有效提高能源效率。HASIB-UR-RAHMAN等[55]将互不相溶的烷醇胺(二乙醇胺,DEA)和疏水性离子液体混合得到一种新型CO2吸收剂,该吸收剂吸收CO2发生固-液分相,固相为易于分离的DEA-氨基甲酸盐晶体。通过动力学研究,发现DEA/离子液的CO2吸收速率随着搅拌速率、CO2分压及温度的升高而增加[56]。此外,HASIB-UR-RAHMAN等[57]进一步对烷醇胺/离子液体混合溶液吸收CO2后形成的固体沉淀的再生性能进行研究。利用差示扫描量热法和热重分析法测定DEA-氨基甲酸盐的热性能,发现DEA-氨基甲酸盐的分解温度仅为55 ℃。较低的再生温度有利于减少溶剂的挥发,同时降低了再生能耗。对于离子液体/有机胺体系,不同离子液体对吸收剂的CO2吸收性能具有显著影响。YU等[58]制备了4种不同离子液体([BF4]、[EMIM][BF4]、[BMIM][PF6]和[EMIM][PF6]),并构建离子液体/MEA二元吸收体系用于CO2吸收。研究结果表明,4种吸收剂中,只有BF4ILs-MEA吸收CO2能产生固相沉淀,其CO2吸收量较不产生固体沉淀的PF6ILs-MEA高30%。

图9 离子液体/MEA溶液
Fig.9 Ionic liquid/MEA solution with MEA-carbamate
除作为溶剂,离子液也可作为吸收活性组分用于构建固-液相变吸收剂。作为活性组分的离子液通常具有氨基基团。ZHANG等[59]以四甲基铵甘氨酸盐([N1111][Gly])和二甲胺基乙氧基乙醇(DMEE)为原料制备新型非水吸收剂用于CO2吸收。在吸收过程中,[N1111][Gly]与CO2反应形成固相沉淀,固相产物很容易从溶液中分离,再生温度为353 K时,产物再生率高达97%,且多次循环吸收后再生率无明显下降。该吸收剂在较低温度下能获得较高再生效率,相比于传统烷醇胺水溶液可大幅降低再生能耗,被认为是一种颇具应用潜力的固-液相变吸收剂。周海铖[60]合成[TETA]Br、[TETA]BF4和[TETA]NO3等离子液体,分别与不同有机溶剂复配,分析不同体系吸收CO2的相变规律,最终优选出[TETA]Br-PMDETA-H2O体系,其在吸收CO2后发生固-液分相,固相在150 ℃下的再生效率可达98.8%,吸收解吸循环4次再生效率仍可达95%。通过13C NMR分析,液相主要为PMDETA,固相主要为CO2产物(氨基甲酸盐、碳酸盐、碳酸氢盐等)。[TETA]Br-PMDETA-H2O吸收CO2的相变机理可能是[TETA]Br与CO2反应生成的氨基甲酸盐发生集聚,导致其在PMDETA中的溶解度降低,进而发生固-液分相[61]。
离子液体作为一种热稳定性好、不易挥发且具有可设计性的绿色溶剂,将其用于构建高效低耗的固-液相变吸收剂具有重大研究意义。但离子液体合成复杂及成本高昂使其推广应用受到限制。因此,开发价格低、吸收性能佳的离子液体将是构建离子液固-液相变吸收剂的关键。
综上所述,几种不同类型的固-液相变吸收剂吸收CO2后,反应产物均能以固体的形式从溶液中沉淀析出。通过固-液两相分离,再生时只需对固相进行解吸,因而具有较大的节能潜力。表1概括了传统MEA溶液和几种典型固-液相变CO2吸收剂的吸附负荷和再生能耗情况。相比于MEA水溶液,大部分固-液相变CO2吸收剂在吸收负荷和节能方面有一定优势。因此,固-液相变CO2吸收剂的开发有望为高效低能耗的CO2捕集提供新的吸收剂选择。
表1 不同类型固-液相变CO2吸收剂与MEA水溶液的吸收负荷和能耗对比
Table 1 Comparison of the CO2 absorption loading and energy consumption between solid-liquid phase-change absorbents and MEA aqueous solution

3 结语与展望
化学吸收法是目前捕集CO2最成熟的方法,但传统有机胺吸收法存在再生能耗高的弊端,如何降低再生能耗将直接关系到CCUS技术的未来走向。固-液相变吸收剂的提出为解决高再生能耗提供了新思路。该类吸收剂在吸收CO2后产物形成固-液两相,CO2主要富集在固相中,只需对固相进行分离用于再生,通过减少进入解吸塔的再生体积大幅降低再生能耗。目前研究者在固-液相变吸收剂的开发与研究方面已取得一定进展。但要实现固-液相变吸收剂的实践应用,今后仍需解决或考虑以下问题:
1)固-液相变吸收剂的构建方法尚未明确,应基于不同相变体系组分的物化特性、捕集CO2的反应机理及相变机制,总结组分筛选的原则,使吸收剂的构建有规律可循;此外,固-液相变吸收剂捕集CO2的热力学、动力学等方面的数据是开发和设计反应器的基础,但目前尚缺乏深入研究。
2)固-液相变吸收剂吸收CO2后,反应产物通过氢键作用发生自聚,形成不溶的固相沉淀。这些固相产物存在大量分子内和分子间氢键,导致其再生分解较为困难。因此,如何改善固相产物的再生性能有待进一步研究。
3)目前大部分固-液相变吸收剂以非水试剂作为溶剂,虽可减小吸收剂对设备的腐蚀、促进分相行为,还可提升吸收速率,但非水体系面临着溶剂易挥发及可能存在二次污染的问题。因此,在实际工艺中应考虑避免溶剂易挥发的方法。
4)对于非水固-液相变吸收剂,在实际工艺应用中,烟气中存在的水蒸气会对CO2捕集造成一定影响。但目前的研究中缺乏含水量对吸收剂捕集CO2的影响,因此,吸收剂含水量对捕集性能、反应机理和相变机理等方面的影响还有待研究,以评估吸收剂在实际中的适用性。
5)相较于传统有机胺吸收工艺,固-液相变捕集技术需增加工艺操作步骤(如固-液两相相分离和再生后与贫相的混合过程等)。因此,如何保持工艺的稳定性和连续性有待深入研究。
[1] DAVISON J. Performance and costs of power plants with capture and storage of CO2[J]. Energy, 2007, 32(7):1163-1176.
[2] BARZAGLI F, MANI F, PERUZZINI M. A comparative study of the CO2 absorption in some solvent-free alkanolamines and in aqueous monoethanolamine (MEA)[J]. Environmental Science & Technology, 2016, 50(13):7239-7246.
[3] VEGA F, BAENA-MORENO F M, GALLEGO FERN NDEZ L M,et al. Current status of CO2 chemical absorption research applied to CCS:Towards full deployment at industrial scale[J]. Applied Energy, 2020, 260:114313-114332.
NDEZ L M,et al. Current status of CO2 chemical absorption research applied to CCS:Towards full deployment at industrial scale[J]. Applied Energy, 2020, 260:114313-114332.
[4] JIANG C K, CHEN H, WANG J L, et al. Phase splitting agent regulated biphasic solvent for efficient CO2 capture with a low heat duty[J]. Environmental Science & Technology, 2020, 54, 7601-7610.
[5] CONWAY W, WANG X, FERNANDES D, et al. Comprehensive kinetic and thermodynamic study of the reactions of CO2(aq) and ![]() with monoethanolamine (MEA) in aqueous solution[J]. Journal of Physical Chemistry A, 2011, 115(50):14340-14349.
with monoethanolamine (MEA) in aqueous solution[J]. Journal of Physical Chemistry A, 2011, 115(50):14340-14349.
[6] PAPADOPOULOS A I, TZIRAKIS F, TSIVINTZELIS I, et al. Phase-change solvents and processes for post combustion CO2 capture:A detailed review[J]. Industrial & Engineering Chemistry Research, 2019, 58(13):5088-5111.
[7] ZHAN X, LV B, YANG K, et al. Dual-functionalized ionic liquid biphasic solvent for carbon dioxide capture:High-efficiency and energy saving[J]. Environmental Science & Technology, 2020, 54(10):6281-6288.
[8] SHEN Y, CHEN H, WANG J, et al. Two-stage interaction performance of CO2 absorption into biphasic solvents:Mechanism analysis, quantum calculation and energy consumption[J]. Applied Energy, 2020, 260:114343-114352.
[9] 安山龙, 汪黎东, 于松华, 等. 相变溶剂捕集CO2技术的研究进展[J]. 化工环保, 2017, 37(1):31-37.
AN Shanlong, WANY Lidong, YU Songhua, et al. Research progresses in CO2 capture technology using phase change solvents[J]. Environmental Protection of Chemical Industry, 2017, 37(1):31-37.
[10] 边阳阳, 申淑锋. 相变吸收剂捕集二氧化碳的研究进展[J]. 河北科技大学学报, 2017, 38(5):460-468.
BIAN Yangyang, SHEN Shufeng. Research progress in carbon dioxide capture using phase-change absorbents[J]. Journal of Hebei University of Science and Technology, 2017, 38(5):460-468.
[11] CHENG J, LI Y, HU L, et al. Characterization of CO2 absorption and carbamate precipitate in phase-change N-methyl-1,3-diaminopropane/N,N-dimethylformamide solvent[J]. Energy & Fuels, 2017, 31(12):13972-13978.
[12] 张政. 有机胺非水体系相变吸收CO2研究[D]. 昆明:昆明理工大学, 2016.
[13] FERRARA G, LANZINI A, LEONE P, et al. Exergetic and exergoeconomic analysis of post-combustion CO2 capture using MEAsolvent chemical absorption[J]. Energy, 2017, 130:113-128.
[14] DUTCHER B, FAN M, RUSSELL A G. Amine-based CO2 capture technology development from the beginning of 2013:A review[J]. ACS Applied Materials & Interfaces, 2015, 7(4):2137-2148.
[15] 张政, 刘彪, 覃显业, 等. 相变溶剂吸收CO2研究进展[J]. 材料导报, 2014, 28(21):94-99.
ZHANG Zheng, LIU Biao, QIN Xianye, et al. Progress in CO2 capture using phase-changing solvents[J]. Materials Reports, 2014, 28(21):94-99.
[16] ZHUANG Q, CLEMENTS B, DAI J, et al. Ten years of research on phase separation absorbents for carbon capture:Achievements and next steps[J]. International Journal of Greenhouse Gas Control, 2016, 52:449-460.
[17] ZHANG S, SHEN Y, WANG L, et al. Phase change solvents for post-combustion CO2 capture:Principle, advances, and chal-lenges[J]. Applied Energy, 2019, 239:876-897.
[18] ZHOU X, JING G, LV B, et al. Low-viscosity and efficient regeneration of carbon dioxide capture using a biphasic solvent regulated by 2-amino- 2-methyl-1-propanol[J]. Applied Energy, 2019, 235:379-390.
[19] CHEN Z, JING G, LYU B, et al. An efficient solid-liquid biphasic solvent for CO2 capture:Crystalline powder product and low heat duty[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(38):14493-14503.
[20] SANCHEZ FERNANDEZ E, HEFFERNAN K, VAN DER HAM L V, et al. Conceptual design of a novel CO2 capture process based on precipitating amino acid solvents[J]. Industrial & Engineering Chemistry Research, 2013, 52(34):12223-12235.
[21] ZHENG S, TAO M, LIU Q, et al. Capturing CO2 into the precipitate of a phase-changing solvent after absorption[J]. Environmental Science & Technology, 2014, 48(15):8905-8910.
[22] TAO M, GAO J, ZHANG P, et al. Biogas upgrading by capturing CO2 in non-aqueous phase-changing diamine solutions[J]. Energy & Fuels, 2017, 31(6):6298-6304.
[23] 陶梦娜. 非水溶剂/多元胺体系的CO2液固相变吸收基础研究[D]. 杭州:浙江大学, 2018.
[24] TAO M, GAO J, ZHANG W, et al. A novel phase-changing nonaqueous solution for CO2 capture with high capacity, thermostability, and regeneration efficiency[J]. Industrial & Engineering Chemistry Research, 2018, 57(28):9305-9312.
[25] 李誉. 三乙烯四胺/有机溶剂吸收剂捕集CO2基础性能研究[D]. 杭州:浙江大学, 2021.
[26] 高金哲. 三乙烯四胺非水吸收剂捕集CO2的微波再生过程研究[D]. 杭州:浙江大学, 2019.
[27] ZHANG Z, ZHAO W, NONG J, et al. Liquid-solid phase-change behavior of diethylenetriamine in nonaqueous systems for carbon dioxide absorption[J]. Energy Technology, 2017, 5(3):461-468.
[28] ZHAO W, ZHAO Q, ZHANG Z, et al. Liquid-solid phase-change absorption of acidic gas by polyamine in nonaqueous organic solvent[J]. Fuel, 2017, 209:69-75.
[29] LI Y, CHENG J, HU L, et al. Phase-changing solution PZ/DMF for efficient CO2 capture and low corro- siveness to carbon steel[J]. Fuel, 2018, 216:418-426.
[30] LI Y, CHENG J, HU L, et al. Regulating crystal structures of EDA-carbamates in solid-liquid phase- changing CO2 capture solutions[J]. Fuel, 2019, 252:47-54.
[31] TAO M, XU N, GAO J, et al. Phase-change mechanism for capturing CO2 into an environmentally benign nonaqueous solution:A combined nmr and molecular dynamics simulation study[J]. Energy & Fuels, 2018, 33(1):474-483.
[32] GAO X, LI X, CHENG S, et al. A novel solid-liquid phase controllable′ biphasic amine absorbent for CO2 capture[J]. Chemical Engineering Journal, 2022, 430:132932.
[33] XU X, MYERS M B, VERSTEEG F G, et al. Next generation amino acid technology for CO2 capture[J]. Journal of Materials Chemistry A, 2021, 9(3):1692-1704.
[34] KUMAR P S, HOGENDOORN J A, FERON P H M, et al. Eq-uilibrium solubility of CO2 in aqueous potassium taurate solutions:Part 1. Crystallization in carbon dioxide loaded aqueous salt solutions of amino acids[J]. Industrial & Engineering Chemistry Research, 2003, 42(12):2832-2840.
[35] WANG X, AKHMEDOV N G, HOPKINSON D, et al. Phase change amino acid salt separates into CO2-rich and CO2-lean phases upon interacting with CO2[J]. Applied Energy, 2016, 161:41-47.
[36] SHEN S, BIAN Y, ZHAO Y. Energy-efficient CO2 capture using potassium prolinate/ethanol solution as a phase-changing absorbent[J]. International Journal of Greenhouse Gas Control, 2017, 56:1-11.
[37] 边阳阳. 脯氨酸钾/乙醇相变吸收剂捕集CO2的应用基础研究[D]. 石家庄:河北科技大学, 2018.
[38] MOHSIN M H, SHARIFF M A, JOHARI K. 3-Dimethylaminopropylamine (DMAPA) mixed with glycine (GLY) as an absorbent for carbon dioxide capture and subsequent utilization[J]. Separation & Purification Technology, 2019, 222:297-308.
[39] MAJCHROWICZ M E, BRILMAN D W F, GROENEVELD M J. Precipitation regime for selected amino acid salts for CO2 capture from flue gases[J]. Energy Procedia, 2009, 1(1):979-984.
[40] BIAN Y, SHEN S. CO2 absorption into a phase change absorbent:Water-lean potassium prolinate/ethanol solution[J]. Chinese Journal of Chemical Engineering, 2018, 26(11):2318-2326.
[41] ALIVAND M S, MAZAHERI O, WU Y, et al. Development of aqueous-based phase change amino acid solvents for energy-efficient CO2 capture:The role of antisolvent[J]. Applied Energy, 2019, 256:113911.
[42] LI H, GUO H, SHEN S. Low-energy-consumption CO2 capture by liquid-solid phase change absorption using water-lean blends of amino acid salts and 2-alkoxyethanols[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(34):12956-12967.
[43] 李慧. 氨基酸盐贫水吸收剂构建及其捕集CO2过程研究[D]. 石家庄:河北科技大学, 2019.
[44] LI H, GUO H, SHEN S. Water-lean blend mixtures of amino acid salts and 2-methoxyethanol for CO2 capture:Density, viscosity and solubility of CO2[J]. Journal of Chemical Thermodynamics, 2020, 150:106237.
[45] OLYAEI E, HAFIZI A, RAHIMPOUR M R. Low energy phase change CO2 absorption using water-lean mixtures of glycine amino acid:Effect of co-solvent [J]. Journal of Molecular Liquids,2021, 336:116286.
[46] 欧阳煌. 氨基酸型温敏相分离吸收剂的制备及性能研究[D]. 武汉:湖北大学, 2019.
[47] ARONU U E, KIM I, HAUGEN G. Evaluation of energetic benefit for solid-liquid phase change CO2 absorbents[J]. Energy Procedia, 2014, 63:532-541.
[48] ANDERSON C, HARKIN T, HO M, et al. Developments in the CO2CRC UNO MK 3 process:A multi-component solvent process for large scale CO2 capture[J]. Energy Procedia, 2013, 37:225-232.
[49] SMITH K, XIAO G, MUMFORD K, et al. Demonstration of a concentrated potassium carbonate process for CO2 capture[J]. Energy & Fuels, 2013, 28(1):299-306.
[50] ZHANG S, YE X, LU Y. Development of a potassium carbonatebased absorption process with crystallization-enabled high-pressure stripping for CO2 capture:Vapor-liquid equilibrium behavior and CO2 stripping performance of carbonate/bicarbonate aqueous systems[J]. Energy Procedia, 2014, 63:665-675.
[51] RAKSAJATI A, HO M T, WILEY D E. Understanding the impact of process design on the cost of CO2 capture for precipitating solvent absorption[J]. Industrial & Engineering Chemistry Research, 2016, 55(7):1980-1994.
[52] YUAN X, ZHANG S, LIU J, et al. Solubilities of CO2 in hydroxyl ammonium ionic liquids at elevated pressures[J]. Fluid Phase Equilibria, 2007, 257(2):195-200.
[53] ZHANG J, ZHANG S, DONG K, et al. Supported absorption of CO2 by tetrabutylphosphonium amino acid ionic liquids[J]. Chemical-A European Journal, 2006, 12(15):4021-4026.
[54] CAMPER D, BARA J E, GIN D L, et al. Room-temperature ionic liquid-amine solutions:Tunable solvents for efficient and reversible capture of CO2[J]. Industrial & Engineering Chemistry Research, 2008, 47(21):8496-8498.
[55] HASIB-UR-RAHMAN M, SIAJ M, LARACHI F. CO2 capture in alkanolamine/room-temperature ionic liquid emulsions:A viable approach with carbamate crystallization and curbed corrosion behavior[J]. International Journal of Greenhouse Gas Control, 2012, 6:246-252.
[56] HASIB-UR-RAHMAN M, LARACHI F. Kinetic behavior of car-bon dioxide absorption in diethanolam-ine/ionic-liquid emulsions[J]. Separation & Purification Technology, 2013, 118:757-761.
[57] HASIB-UR-RAHMAN M, LARACHI F. CO2 capture in alkanolamine-RTIL blends via carbamate crystallization:Route to efficient regeneration[J]. Environmental Science & Technology, 2012, 46(20):11443-11450.
[58] YU G, FAN S, CHEN X, et al. CO2 absorption by binary mixture of ionic liquids-monoethanolamine at lower pressure[J]. International Journal of Greenhouse Gas Control, 2016, 44:52-58.
[59] ZHANG F, GAO K X, MENG Y N, et al. Intensification of dimethyaminoethoxyethanol on CO2 absorption in ionic liquid of amino acid[J]. International Journal of Greenhouse Gas Control, 2016, 51:415-422.
[60] 周海铖. 离子液体相变体系在CO2捕集中的应用研究[D]. 北京:北京化工大学, 2020.
[61] ZHOU H, XIAO X, CHEN C, et al. Novel ionic liquids phase change solvents for CO2 capture[J]. International Journal of Greenhouse Gas Control, 2020, 98:103068.
Research progress on carbon dioxide capture using solid-liquid phase-change absorbents

移动阅读