钙钛矿锚定纳米氧化铈及其化学链干重整性能
0 引 言
天然气作为一种主要用于生产合成气的清洁环保能源,在化学工业中尤为重要[1-3]。目前利用甲烷(CH4)制备合成气的主要途径包括甲烷水蒸气重整、自热重整、二氧化碳(CO2)干重整和部分氧化[4-6]。MATTISSON等[7]2001年提出了将化学链技术引入重整过程的新工艺,即化学链重整(CLR)。在化学链CH4干重整工艺中,在还原阶段,氧载体释放晶格氧部分氧化CH4生成CO和H2,在氧化阶段,通入CO2恢复氧载体在还原阶段消耗的晶格氧。因此,氧载体储氧和释氧能力是化学链技术的关键[8]。此外,化学链交替进料避免了燃料与空气的直接接触,防止有害气体释放,节约气体分离所需的能量。
与贵金属(Pt[9],Au[10],Rh[11],Pd[12])在甲烷干重整中的应用相比,Ni基催化剂因其成本较低和可在中温条件下活化甲烷和二氧化碳的独特优势,常被用于甲烷干重整[13]。在众多载体中(SiO2[14],TiO2[15],CeO2[16],Al2O3[17]和合金固溶体[18-21]等),CeO2由于其优异的储释氧能力、丰富的氧空位、Lewis碱性特征及具有甲烷和CO2活化的主要基团而备受关注。因此,结合Ni和CeO2材料的特性,在众多的研究中,它们往往以Ni/CeO2的形式被广泛应用[4,14,22]。在过去的研究中,CAO等[23]利用Ni在氧化铈基材料上良好的分散特性及CeO2较强的CO2活化特性和丰富的氧空位,制备了纳米金属Ni表面分布的Ni/CeZrO2-δ氧载体,实现了高效中温化学链制合成气。钙钛矿型过渡金属混合氧化物,一般化学式为ABO3,其中A位为镧、钡、钙离子或其组合;B位为过渡金属(Fe、Mn、Cu、Co等)离子。在钙钛矿A/B位的性能调控中,A位阳离子决定了晶格空位的形成,并且可在不同的晶格中形成不同的空位。HE等[24]选取Sr2 进行部分取代制备La1-xSrxFeO3(x=0.1、0.3、0.5、0.7、1.0)氧载体。发现Sr2 的引入不仅可以有效抑制甲烷裂解,且可以保持良好的稳定性。与钙钛矿A位离子特征相比,B位阳离子被认为会影响氧载体的催化活性。NALBANDIAN等[25]制备了用于CL-DRM反应的La1-xSrxMyFe1-yO3-δ(M=Ni,Co,Cr,Cu)氧载体。研究表明,掺杂过渡金属导致晶格的微观结构缺陷,从而提高氧载体的反应活性。鉴于Ni、CeO2和钙钛矿材料的相关特性,许多研究者对其进行拓展研究,并用于甲烷的干重整[26-27]。WANG等[26]在LaNi1-xFexO3的A位掺入Ce,通过活化B位金属阳离子引入更多的氧空位。同时,Ce元素通过氧化还原以Ce3 /Ce4 的形式存在于(LaCe)(NiFe)O3和CeO2中。在氧化还原过程中,为氧化还原阶段的转变提供了驱动力,并且Ni、CeO2、(LaCe)(NiFe)O3等物种也增强了催化性能。但对活性物种(Ni、CeO2等)负载于钙钛矿型载体上作为氧载体用于甲烷化学链干重整还鲜少研究。基于此,笔者提出通过在钙钛矿上负载Ni/CeO2得到(Ni/CeO2)/La0.8Sr0.2FeO3氧载体用于甲烷化学链干重整(CL-DRM)制合成气工艺。该工艺由CH4部分氧化(还原阶段)和CO2分解(氧化阶段)两个阶段组成,在800 ℃条件下制合成气。此外探讨了反应过程中的合成气生成的反应机理,并通过调控CeO2的粒径,进一步促进了氧载体在甲烷化学链干重整反应中的反应活性。
1 试 验
1.1 催化剂制备
1.1.1 不同钙钛矿制备
通过溶胶-凝胶法合成不同钙钛矿。将化学计量比的硝酸盐前驱体按一定比例加入去离子水中,然后向溶液中加入一定量的柠檬酸(金属阳离子:柠檬酸=1:2),在80 ℃的水浴锅中搅拌30 min。待溶解后,在溶液中加入适量乙二醇(柠檬酸:乙二醇=1:1.5),搅拌至形成溶胶-凝胶,然后将凝胶在120 ℃下干燥12 h。干燥后的样品在空气中以5 ℃/min的升温速率在800 ℃下煅烧3 h。
1.1.2 不同负载Ni/CeO2钙钛矿制备
采用湿浸渍法制备了一系列质量分数x%(Ni/CeO2)/LaSrFeO3样品。按Ni:Ce质量比1:9将Ni(NO3)2·6H2O和Ce(NO3)·6H2O溶于去离子水中,在60 ℃下搅拌3 h。然后将制备好的LaSrFeO3缓慢加入到上述溶液中,继续搅拌至水分完全蒸发,置于120 ℃的烘箱中12 h。所得样品在800 ℃下煅烧90 min,最终形成一系列x%(Ni/CeO2)/LaSrFeO3样品。为调节CeO2的粒径,除采用浸渍法以外,还采用共沉淀法和水热法制备质量分数20%(Ni/CeO2)/LaSrFeO3氧载体。共沉淀法:按Ni:Ce质量比1:9将Ni(NO3)2·6H2O、Ce(NO3)·6H2O溶解于去离子水中并搅拌均匀。然后将制备好的LaSrFeO3缓慢加入到上述溶液中,并继续搅拌。使用滴定法加入沉淀剂NH3·H2O,滴加至pH在9.5~10.0,并有沉淀物产生。待完全沉淀后,将所得沉淀物老化3 h,并抽滤洗涤,所得沉淀物物在80 ℃的条件下干燥12 h。所得样品在800 ℃下煅烧3 h,最终得到质量分数20%(Ni/CeO2)/LaSrFeO3氧载体。水热法:按Ni∶Ce质量比1∶9将Ni(NO3)2·6H2O、Ce(NO3)·6H2O溶解于去离子水中,并搅拌均匀。然后将制备好的LaSrFeO3缓慢加入到上述溶液中,并继续搅拌。使用滴定法加入沉淀剂NH3·H2O,滴加至pH在9.5~10.0,并有沉淀物产生,待完全沉淀后,将混合溶液转移到聚四氟乙烯内衬不锈钢高压釜中,将高压釜转移至干燥箱中,并在110 ℃下水热处理24 h。水热处理后冷却到室温,将所得沉淀分离洗涤,所得沉淀物物在80 ℃干燥12 h。所得样品在800 ℃下煅烧3 h,最终得到质量分数20%(Ni/CeO2)/LaSrFeO3氧载体。
1.1.3 催化剂表征
采用X射线衍射仪(XRD,Rigaku,Japan)和CuKα射线(40 kV,20 mA)对氧载体的晶相和结构进行表征,衍射角2θ为10°~90°,扫描速率5°/min,间隔0.02°记录。
在TPR Win V1.50化学吸附仪(Quantachrome Instruments,USA)上,以5% H2/Ar混合气(流量75 mL/min)为载气,以10 ℃/min的升温速率,从25~800 ℃对制备的氧载体进行氢气程序升温还原(H2-TPR)表征其还原性能。
采用高分辨率透射电子显微镜(TEM,Tecnai G2 TF30 S-Twine)对氧载体的微观形貌进行表征。
样品在Thermo Scientific K-Alpha仪器上测试XPS数据。激发源:AlKα射线(hv=1 486.6 eV),束斑:400 μm,分析室真空度优于5.0×10-5 Pa,工作电压:12 kV,灯丝电流:6 mA,全谱扫描:通能量100 eV,步长1 eV;窄谱扫描:通能量50 eV,步长0.05 eV,结合能校正:以C1s=284.80 eV结合能为能量标准进行电荷校正。
1.1.4 氧载体反应性能评价
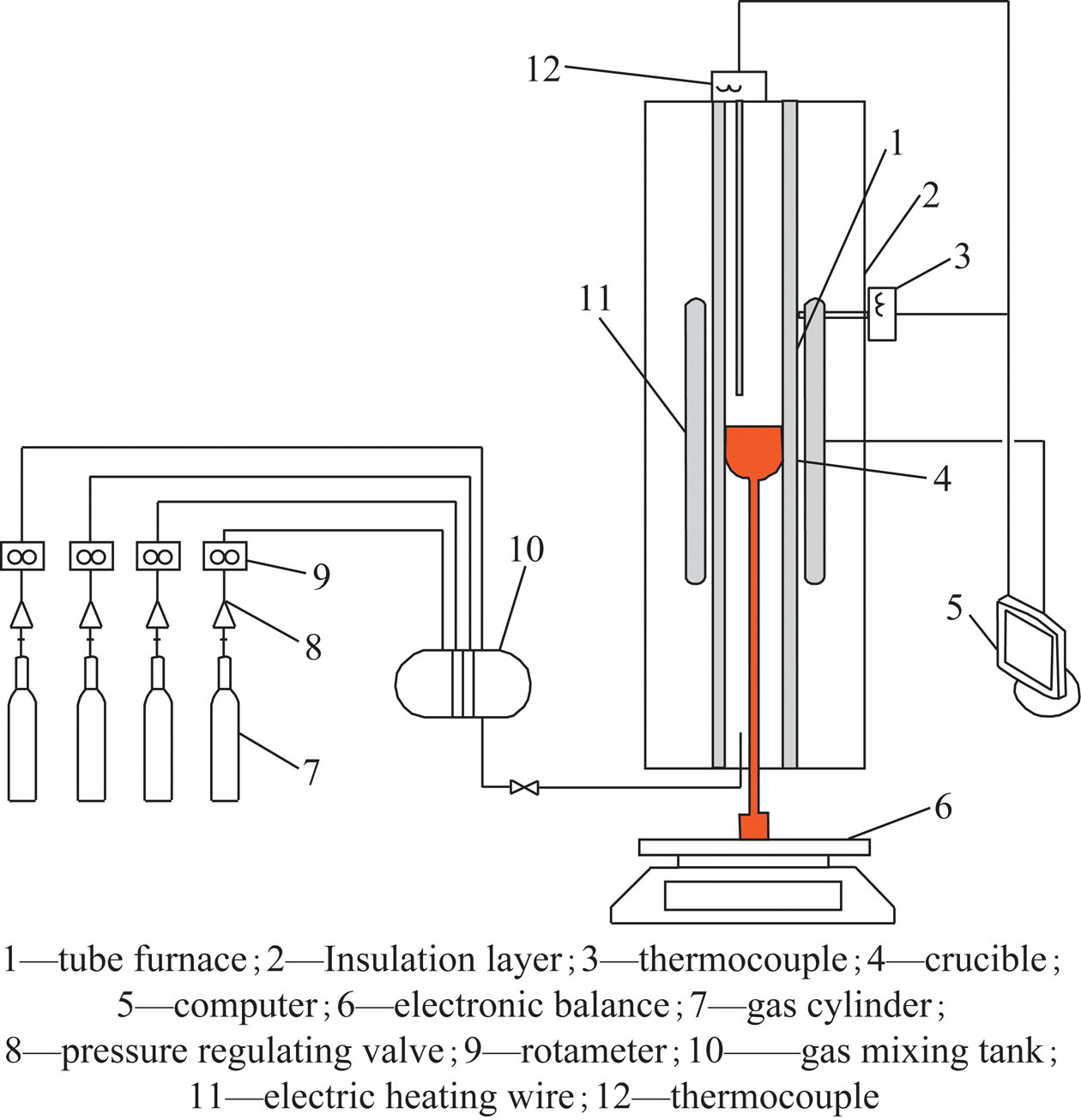
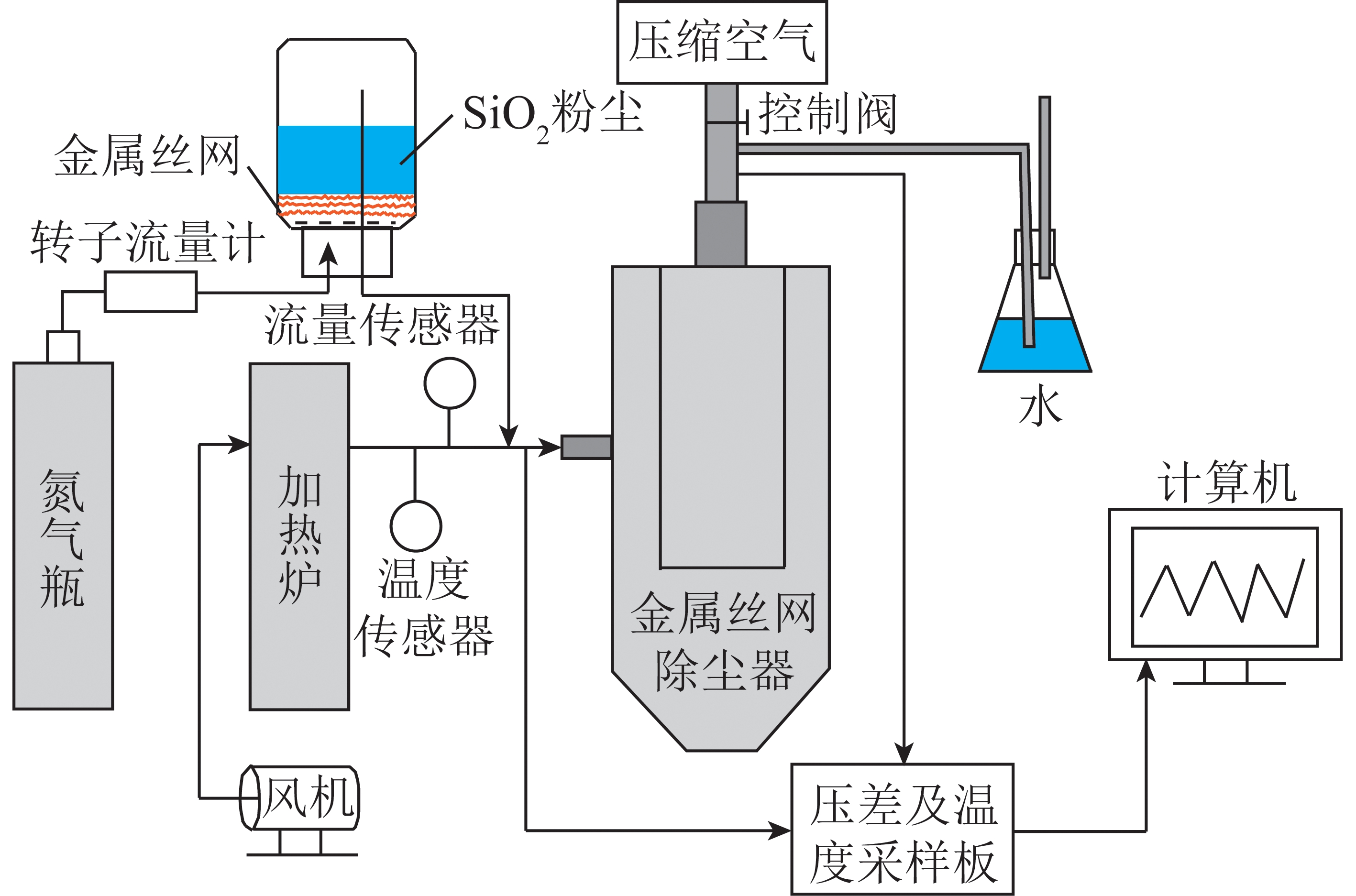
氧载体活性评价均在自行搭建的常压固定床气体反应装置中进行,装置如图1所示。将300 mg催化剂装于U型管中,用50 mL/min的高纯氩气吹扫进行预处理。然后将含有5% CH4的CH4/Ar混合气在反应温度下通入反应器,以50 mL/min的流量对样品进行CH4程序升温反应(CH4-TPR)试验。

图1 试验评价装置示意
Fig.1 Schematic diagram of the performance evaluation device
还原结束后,在试验条件下进行CO2的程序升温氧化(CO2-TPO)试验,使用5% CO2的CO2/Ar混合气进行氧载体氧化。CH4氧化还原恒温试验中,在还原阶段,800 ℃条件下,将5% CH4的CH4/Ar混合气通入反应器中,气体流速为50 mL/min,在反应20 min后将气体转换为用Ar吹扫20 min,然后将气体转换为5% CO2/Ar反应20 min。氧载体稳定性试验,在800 ℃条件下,将恒温试验进行循环,在每个氧化还原周期之间,使用高纯氩气进行吹扫20 min。采用质谱(LC-D200M PRO,TILON)对出口气体进行分析,并用标准混合气体对质谱仪进行校准。
根据以下公式计算了反应中CH4和CO2的转化率、CO选择性和H2/CO:
X(CH4)=(n(CH4)in-n(CH4)out)/n(CH4)in×100%,
(1)
X(CO2)=(n(CO2)in-n(CO)out)/n(CO2)in×100%,
(2)
S(CO)=n(CO)out/(n(CO2)out n(CO2)out)×100% ,
(3)
式中,X为转化率;S为选择性。
1 结果与讨论
1.2 钙钛矿氧载体的筛选
通过CH4-TPR、CO2-TPO和恒温氧化还原测试研究不同钙钛矿对甲烷的氧化还原性能(表1和图2, 图2反应条件:催化剂质量300 mg,反应温度800 ℃;反应气体流量50 mL/min;反应气5% CH4/Ar、5% CO2/Ar、Ar)。各钙钛矿的CO选择性和CH4转化率如图2所示,所有Ba基钙钛矿表现出较低的CH4转化率和CO选择性,并伴随显著的CH4裂解,这归因于中温条件下Ba基钙钛矿存在的过量晶格氧[28]。Ca基钙钛矿在CH4转化率和CO选择性方面表现出与钡基钙钛矿相似的性能。相比之下,所制备的La基钙钛矿均具有较好的催化性能,CH4转化率均高于70%,CO选择性显著提高,同时达到了理想的H2/CO比接近2.0的合成气。不同钙钛矿的物理化学性质见表1。与Ba基和Ca基钙钛矿相比,La基钙钛矿晶粒尺寸较大。随着A/B位的调整,由于Sr2 颗粒在一定程度上掺入晶格,La0.8Sr0.2FeO3的晶粒尺寸增至350 nm[29]。在化学链氧化还原过程中,氧载体中的晶格氧取代传统工艺中的分子氧,因此要求氧载体具有强储释氧能力。
表1 各钙钛矿的物理性质
Table 1 Mineral properties of each perovskite


图2 各钙钛矿的CO选择性和CH4转化率
Fig.2 CO selectivity and CH4 conversion of each perovskite
对于表1中列出的钙钛矿物种储氧能力,对应的La0.8Sr0.2FeO3表现出较高的转化率和选择性。由此推断,氧载体储氧能力的提高是化学链干重整的关键因素[30]。因此,以La0.8Sr0.2FeO3钙钛矿为基础进行改性用于后续研究。
2.2 氧载体的表征
不同Ni/CeO2负载量的x%(Ni/CeO2)/LaSrFeO3(x=10、20、30)氧载体的XRD图谱如图3(a)所示。所有样品均观察到与LaSrFeO3结构相对应的特征峰,表明LaSrFeO3钙钛矿结构纯度较高且结晶良好。不同负载量Ni/CeO2改性后,图谱中逐渐显现出明显的CeO2衍射峰,但未观察到NiO或Ni相衍射峰,这也许是由于Ni相含量低未达到仪器测试要求,或是Ni相分散度高。此外,所有(Ni/CeO2)/LaSrFeO3复合材料具有相似的晶体结构。位于2θ=22.8°、32.48°、39.9°、46.5°、57.7°、67.9°、77.3°的衍射峰分别归属于LaSrFeO3钙钛矿(101)、(121)、(220)、(202)、(240)、(204)晶面的映射[31],表明负载Ni/CeO2后钙钛矿的晶体结构得以保持。28.51°处的衍射峰与CeO2(111)晶面的反射有关,且随CeO2负载量的增加更加明显[32]。随Ni/CeO2负载量增加,氧载体的特征衍射峰向高角度偏移,同时其半峰宽增加,衍射峰强度减弱,说明随Ni/CeO2负载量增加,氧载体的晶粒尺寸逐渐减小。

图3 x% (Ni/CeO2)/LaSrFeO3(x =0、10、20、30)的 XRD图谱和H2-TPR图谱
Fig.3 XRD pattern and H2-TPR pattern of x% (Ni/CeO2)/LaSrFeO3 (x=0、10、20、30)
同时,利用H2-TPR探究Ni/CeO2的负载对La0.8Sr0.2FeO3还原性能的影响,如图3(b)所示。氧载体在400 ℃以下出现的还原峰归因于表面吸附氧的还原及高价态Ni部分被还原消耗的H2。400~600 ℃的还原峰与Fe、Ni离子的还原有关。600 ℃以上的还原峰归因于金属Ni、Fe和Ni-Fe合金的深度还原[33]。由图3(b)可知,随Ni/CeO2负载量增加,由于Ce和Fe物种之间的相互作用,还原峰的起始温度向低温移动。当Ni/CeO2负载量为30%时,还原峰不再向低温方向移动,说明Ni/CeO2负载量的进一步增加不再改变样品的还原性能。随Ni/CeO2负载量增加,400~600 ℃的峰强度先增强,在负载量为20%时达到最大值。当Ni/CeO2的负载量达到30%时,600 ℃以上的还原峰急剧增加,表明过量的Ni掺杂比例可能导致复合材料深度还原形成Ni和Fe,这可能是甲烷裂解形成积碳的原因[34]。以上结果表明,合适的Ni/CeO2负载量可以提高LaSrFeO3的储释氧能力。
氧载体表面元素的组成和价态对其氧化还原性能有重要的影响。采用XPS对样品表面进行研究分析。通过对(Ni/CeO2)/LaSrFeO3样品的O 1s和Fe 2p谱进行分峰拟合和定量分析,结果如图4和表2所示。在533.5 eV(标记为OI)、532 eV(标记为OII)和529.2 eV(标记为OⅢ)处观察到3个明显的氧信号(图4(a)),分别对应羟基和/或碳酸盐物种、表面吸附氧和表面晶格氧[35]。在3种氧物种中,晶格氧有利于CH4部分氧化,而与氧缺陷相关的吸附氧或低配位的表面分子氧有利于CH4的完全氧化[36]。随Ni/CeO2负载量增加,由于金属离子价态开始降低,晶格氧峰(OⅢ)略有降低,从而降低晶格氧含量,与氧空位数量的增加相匹配。同时,部分分子氧可以吸附在氧空位上,进一步富集表面吸附氧(OII)[37]。然而,当Ni/CeO2负载量增至30%时,氧空位浓度并未进一步增加。在样品的Fe 2p谱中,723、710.2和718.5 eV附近的特征峰对应Fe3 ,而在结合能较低的709.7 eV处的峰则与Fe2 有关。随Ni/CeO2负载量增加,Fe2 /(Fe3 Fe2 )比值增加。表明Ni/CeO2的存在有利于CeO2-LaFeSrO3相互作用形成Fe2 ,进而形成更多的氧缺陷[8,38]。
表2 x%(Ni/CeO2)/LaSrFeO3样品的XPS特征
Table 2 XPS-derived characteristics for the x%(Ni/CeO2)/LaSrFeO3samples


图4 x% (Ni/CeO2)/LaSrFeO3样品XPS图谱
Fig.4 XPS images of x%(Ni/CeO2)/LaSrFeO3 sample
2.3 氧载体的筛选
甲烷重整为吸热过程,需要较高的温度才能达到理想的转化水平。通过CH4-TPR和恒温氧化还原试验评价Ni/CeO2负载量对催化剂氧化还原性能的影响。催化剂的CH4-TPR曲线及氧化还原循环性能比较如图5所示,由图5(a)和5(b)可知,随Ni/CeO2质量分数由0增至30%,还原过程中甲烷部分氧化的起始温度由700 ℃降至625 ℃。La0.8Sr0.2FeO3在低于700 ℃时没有催化活性,在CH4-TPR曲线中,合成气中的H2和CO的比值小于2。相比之下,CH4转化率随温度的升高几乎呈线性增加,CO和H2的选择性也随之增加,这是由于高温促进了甲烷分解,从而提高CH4的转化率[39]。此外,随样品中Ni/CeO2含量增加,2种甲烷活化产物(CO和H2)呈现相似的增加趋势。说明Ni/CeO2对C—H活化有一定促进作用,从而促进甲烷重整制合成气。此外,对于所有(Ni/CeO2)/LaSrFeO3样品,观察到复合材料的H2浓度是CO浓度的2倍以上,表明由于甲烷裂解的发生产生了氢气和积碳。800 ℃时,较高的H2浓度和CO的轻微减少提供了很好的证明。

图5 催化剂的CH4-TPR曲线及氧化还原循环性能比较
Fig.5 CH4-TPR curves and comparison of REDOX cycle performance
不同负载量(Ni/CeO2)/LaSrFeO3氧载体在CH4-CO2氧化还原循环过程中H2/CO平均物质的量比如图5(d)所示。质量分数分别为20%和30% Ni/CeO2负载样品的合成气产率较高。20%(Ni/CeO2)/LaSrFeO3的H2/CO物质的量比接近2.0。甲烷重整反应中,Ni/CeO2负载量较高(30%)的样品产生合成气的H2/CO物质的量比高于理论理想值2.0,表明Ni/CeO2高负载量导致CH4在还原阶段被裂解生成了H2和积碳[40-41]。不同负载量氧载体上的CH4转化率和选择性如图5(c)所示,可知当Ni/CeO2质量分数由0增至20%时,CH4转化率由75%增大到约90%,所有样品的选择性接近90%,其中20%(Ni/CeO2)/La0.8Sr0.2FeO3氧载体的性能最佳。
2.4 氧载体的氧化还原稳定性测试
对20%(Ni/CeO2)/La0.8Sr0.2FeO3进行稳定性测试,探究其在800 ℃下氧化还原循环过程中的性能稳定性。水热负载样品的30个氧化还原循环如图6所示,反应条件为:催化剂质量为300 mg;反应气流量为50 mL/min(5% CH4/Ar)、50 mL/min(5% CO2/Ar),50 mL/min(Ar)。由图6(a)可知,在CH4部分氧化的起始阶段,CO体积分数显著增加,与H2体积分数趋势相似,直至CH4进料稳定阶段,CO和H2体积分数达到稳定。CH4部分氧化过程中的H2/CO物质的量比超过理论甲烷选择性氧化中的理想值,表明甲烷裂解为积碳和H2。同时由于CH4完全氧化为CO2和H2O,开始时出现了微弱的CO2浓度信号,并且在此过程中CH4转化率较高。整个CH4部分氧化过程在氧载体的作用下发生了完全氧化、甲烷部分氧化和甲烷裂解。在氧化阶段,引入CO2对还原后的氧载体进行再氧化恢复晶格氧,并对积碳进行气化。在CO2裂解过程中,由图6(a)可以观察到CO体积分数先升高后降低,说明在此过程中氧载体表面积碳被CO2氧化生成CO直至氧载体恢复。

图6 水热负载样品的30个氧化还原循环
Fig.6 30 redox cycles of hydrothermal loaded samples
图6(b)显示了连续30次氧化还原循环中氧载体的性能,氧载体选择性在过程开始时较低,在循环过程中持续增加。这可能是由于引入CeO2进一步增加了氧空位浓度,提高了氧释放速率,与甲烷的部分氧化速率相匹配[42]。整个气固反应趋向于部分氧化,甲烷裂解被抑制,积碳减少,这也从H2/CO比不断降低接近理想值(2.0)上得到了证明。在长期循环过程中,氧载体表现出稳定的转化率和较高的选择性。晶格氧在控制CO选择性方面起着关键作用。在氧化阶段,CO2分解恢复氧载体中的晶格氧。因此,生成CO的活性氧物种在样品中可被恢复,而生成CO2的活性氧物种几乎不被恢复,使氧载体在循环过程保持高性能稳定性。同时研究发现,在循环过程中,氧载体的选择性不断提高,氢碳比逐渐接近理论值2。这些结果表明,(Ni/CeO2)/LaSrFeO3氧载体在较长时间循环过程中性能稳定,无明显失活现象,这是由于氧载体具有较强的抗烧结和抗积碳性能。
2.5 CeO2颗粒尺寸调控的反应行为
根据不同合成方法制备一系列质量分数20%(Ni/CeO2)/LaSrFeO3催化剂,考察CeO2粒径对氧载体氧化还原性能的影响。在CH4部分氧化阶段(图7),水热法制备的样品对H2和CO的选择性有所提高,这是由于较小的CeO2粒径影响Ni相分散,从而导致更多的活性位点,提高了氧载体的催化活性。CeO2小粒径样品的氧迁移速率比大粒径样品更快,且与CH4解离速率一致[43],使CH4的转化率提高至87%以上。不同合成方法所得CeO2颗粒见表3。
表3 不同方法负载的CeO2纳米粒子的粒径
Table 3 Particle size of CeO2 nanoparticles loaded by different methods


图7 800 ℃恒温图
Fig.7 800 ℃ Constant temperature diagram
图8给出(Ni/CeO2)/LaSrFeO3氧载体循环30次后的EDS、TEM和HRTEM测试结果。由图8(a)可知,对于图中第30次循环后样品Ni和Ce元素区域仍与La、Sr和Fe元素区域重叠,表明质量分数20% (Ni/CeO2)/La0.8Sr0.2FeO3表面的Ni和Ce在循环30次后均匀分散,Ni颗粒被CeO2保护不被烧结,这与恒温反应前观察结果一致。质量分数20%(Ni/CeO2)/La0.8Sr0.2FeO3的微观结构在30次循环氧化还原测试后保持稳定,有助于化学链氧化还原循环过程保持高性能稳定性。此外,由图8(d)可知LaSrFeO3基氧载体表面有Ni单质颗粒。图8(b)和图8(c)显示Ni颗粒在LaSrFeO3上的分散,同时表明载体LaSrFeO3在30个循环后仍保持钙钛矿结构。

图8 30次循环后样品的EDS、TEM和HRTEM图
Fig.8 EDS, TEM and HRTEM images of the sample after 30 cycles
3 结 论
1)20%(Ni/CeO2)/La0.8Sr0.2FeO3复合材料的CH4转化率超过87%,CO选择性超过90%,H2/CO物质的量比为2.18,为在中温还原/氧化气氛中制备具有高热稳定性和结构稳定性的氧载体提供了参考。
2)CeO2与载体La0.8Sr0.2FeO3相互作用有利于钙钛矿形成氧空位,从而增强其氧迁移能力。Ni/CeO2的负载提高了氧载体的储氧性能,增强其反应活性,从而提高氧载体对甲烷的转化率和对H2和CO的选择性。Ni/CeO2的负载提高了氧载体的储氧性能,增强了其反应活性,降低了反应初始温度。
3)水热法制备的小粒径CeO2纳米颗粒,使Ni相颗粒在(Ni/CeO2)/LaSrFeO3复合材料的表面均匀分散,提高氧载体的反应活性,增加了CH4的转化率和H2/CO的选择性,并保护Ni颗粒在800 ℃条件下长期循环不被烧结。
[1] ZHU X, LI K, LI F. Perovskites as geo-inspired oxygen storage materials for chemical looping and three-way catalysis: A perspective[J]. ACS Catalysis, 2018,8(9).
[2] ZHU X, IMTIAZ Q, LI F. Chemical looping beyond combustion:A perspective[J]. Energy &Environmental Science, 2020,13:772-804.
[3] 方圆,张万益,曹佳文,等.我国能源资源现状与发展趋势[J].矿产保护与利用,2018(4):34-42,47.
FANG Yuan, ZHANG Wanyi, GAO Jiawen, et al. Analysis on the current situation and development trend of energy resources in China[J]. Conservation and Utilization of Mineral Resources, 2018(4):34-42,47.
[4] HAN K H, YU W S, XU L L,et al. Reducing carbon deposition and enhancing reaction stability by ceria for methane dry reforming over Ni@SiO2@CeO2 catalyst[J]. Fuel, 2021,291:120182.
[5] AZIZ M A A, SETIABUDI H D, TEH L P, et al. A review of heterogeneous catalysts for syngas production via dry reforming[J]. Journal of the Taiwan Institute of Chemical Engineers, 2019,101:139-158.
[6] 陈吉祥, 王日杰, 张继炎,等.甲烷与二氧化碳重整制取合成气研究进展[J]. 化学与化工, 2003,28: 32-37.
CHEN Jixiang, WANG Rijie, ZHANG Jiyan, et al. Progress of study on carbon dioxide reforming of methane to synthesis gas[J]. Natural Gas Chemical Industry, 2003,28: 32-37.
[7] MATTISSON T, LYNGFELT A, CHO P. The use of iron oxide as an oxygen carrier in chemical-looping combustion of methane with inherent separation of CO2[J]. Fuel, 2001,80:1953-1962.
[8] CHEN Y P, ZHU X, LI K Z. Chemical looping co-splitting of H2O-CO2 for efficient generation of syngas[J]. Acs Sustainable Chemistry &Engineering, 2019,7:15452-15462.
[9] NIU J T, WANG Y L, LILAND S E. Unraveling enhanced activity, selectivity, and coke resistance of Pt-Ni bimetallic clusters in dry reforming[J]. Acs Catalysis, 2021,11:2398-2411.
[10] HORVATH A, GUCZI L, KOCSONYA A. Sol-derived AuNi/MgAl2O4 catalysts: Formation, structure and activity in dry reforming of methane[J]. Applied Catalysis A:General, 2013,468:250-259.
[11] YENTEKAKIS I V, GOULA G, HATZISYMEON M. Effect of support oxygen storage capacity on the catalytic performance of Rh nanoparticles for CO2 reforming of methane[J]. Applied Catalysis B:Environmental, 2019, 243:490-501.
[12] BALLESTEROS-PLATA D, INFANTES-MOLINA A, RODRIGU-
EZ-CASTELLON E. Improving noble metal catalytic activity in the dry reforming of methane by adding niobium[J]. Fuel, 2022, 308:121996.
[13] DENG J, BU K K, SHEN Y J. Cooperatively enhanced coking resistance via boron nitride coating over Ni-based catalysts for dry reforming of methane[J]. Applied Catalysis B:Environmental, 2022,302:120859.
[14] HAN K H, YU S Y, WANG Y. Confining Ni and ceria in silica shell as synergistic multifunctional catalyst for methane dry reforming reaction[J]. Journal of Power Sources, 2021, 506:230232.
[15] SHAH M, AL MESFER M K, DANISH M. Effect of titania synthesis conditions on the catalytic performance of mesoporous Ni/TiO2 catalysts for carbon dioxide reforming of methane[J]. International Journal of Hydrogen Energy, 2022, 47:8867-8874.
[16] RASHID M U, DAUD W, MOHIDEM N A. Methane dry reforming with CO2 over ceria supported Ni catalyst prepared by reverse microemulsion synthesis[J]. Fuel, 2022, 317:123433.
[17] KWON Y, EICHLER J E, MULLINS C B. NiAl2O4 as a beneficial precursor for Ni/Al2O3 catalysts for the dry reforming of methane[J]. Journal of CO2 Utilization, 2022,63:250081708.
[18] CAO Z S, ZHU X, LI K Z. Moderate -temperature chemical looping splitting of CO2 and H2O for syngas generation[J]. Chemical Engineering Journal, 2020, 397:218938102.
[19] KHANI Y, BAHADORAN F, SHARIATINIA Z. Synthesis of highly efficient and stable Ni/CexZr1-xGdxO4 and Ni/X-Al2O3 (x=Ce, Zr, Gd, Ce-Zr-Gd) nanocatalysts applied in methane reforming reactions[J]. Ceramics International, 2020, 46:25122-25135.
[20] ZHANG F, LIU Z Y, CHEN X B. Effects of Zr doping into ceria for the dry reforming of methane over Ni/CeZrO2 catalysts: In situ studies with XRD, XAFS, and AP-XPS[J]. Acs Catalysis, 2020, 10:3274-3284.
[21] MARINHO A L A, TONIOLO F S, NORONHA F B. Highly active and stable Ni dispersed on mesoporous CeO2-Al2O3 catalysts for production of syngas by dry reforming of methane[J]. Applied Catalysis B:Environmental, 2021,281:224860799.
[22] QIN Z Z, CHEN L Y, CHEN J.Ni/CeO2 prepared by improved polyol method for DRM with highly dispersed Ni[J]. Greenhouse Gases:Science and Technology, 2021,11:1245-1264.
[23] CAO Z, ZHU X, LI K. Moderate-temperature chemical looping splitting of CO2 and H2O for syngas generation[J]. Chemical Engineering Journal, 2020,397:125393.
[24] HE F, CHEN J, LIU S. La1-xSrxFeO3 perovskite-type oxides for chemical-looping steam methane reforming: Identification of the surface elements and redox cyclic performance[J]. International Journal of Hydrogen Energy, 2019, 44:10265-10276.
[25] NALBANDIAN L, EVDOU A, ZASPALIS V. La1-xSrxMyFe1-yO3-δ perovskites as oxygen-carrier materials for chemical-looping reforming[J]. International Journal of Hydrogen Energy, 2011, 36: 6657-6670.
[26] WANG M, ZHAO T T, DONG X L. Effects of Ce substitution at the A-site of LaNi0.5Fe0.5O3 perovskite on the enhanced catalytic activity for dry reforming of methane[J]. Applied Catalysis B-Environmental, 2018,224:214-221.
[27] KWON O, HUANG R J, CAO T Y. Dry reforming of methane over Ni supported on LaMnO3 thin films[J]. Catalysis Today, 2021,382:142-147.
[28] DING H, JIN Y, HAWKINS S C. Development and performance of CeO2 supported BaCoO3-δ perovskite for chemical looping steam methane reforming[J]. Fuel Processing Technology, 2023,239:107546.
[29] YIN X, SHEN L, WANG S. Double adjustment of Co and Sr in LaMnO3 δ perovskite oxygen carriers for chemical looping steam methane reforming[J]. Applied Catalysis B: Environmental, 2022, 301:120816.
[30] ZHAO K, ZHANG R, GAO Y. High syngas selectivity and near pure hydrogen production in perovskite oxygen carriers for chemical looping steam methane reforming[J]. Fuel Processing Technology, 2022, 236:107398.
[31] ZHAO K, HE F, HUANG Z. Perovskite-type oxides LaFe1-xCoxO3 for chemical looping steam methane reforming to syngas and hydrogen co-production[J]. Applied Energy, 2016, 168:193-203.
[32] LUISETTO I, TUTI S, DI BARTOLOMEO E. Co and Ni supported on CeO2 as selective bimetallic catalyst for dry reforming of methane[J]. International Journal of Hydrogen Energy, 2012,37:15992-15999.
[33] LI X, LI Z, LU C. Enhanced performance of LaFeO3 oxygen carriers by NiO for chemical looping partial oxidation of methane[J]. Fuel Processing Technology, 2022, 236:107396.
[34] ZHU Y, JIN N, LIU R, et al. Bimetallic BaFe2MAl9O19(M=Mn, Ni, and Co) hexaaluminates as oxygen carriers for chemical looping dry reforming of methane[J]. Applied Energy, 2020, 258:114070.
[35] LI D Y, XU R D, GU Z H. Chemical-looping conversion of methane: A review, energy technology[J]. Energy Technology, 2020, 8:1900925.
[36] QIN L, GUO M Q, LIU Y. Enhanced methane conversion in chemical looping partial oxidation systems using a copper doping modification[J]. Applied Catalysis B:Environmental, 2018, 235:143-149.
[37] ZHU X, LI K Z, LI F X. Perovskites as GeO-inspired oxygen storage materials for chemical looping and three-way catalysis: A perspective[J]. Acs Catalysis, 2018, 8:8213-8236.
[38] LOFBERG A, KANE T, GUERRERO-CABALLERO J. Chemical looping dry reforming of methane: Toward shale-gas and biogas valorization[J]. Chemical Engineering and Processing-Process Intensification, 2017, 122:523-529.
[39] SCHRENK F, LINDENTHAL L, DREXLER H. Impact of nanoparticle exsolution on dry reforming of methane: Improving catalytic activity by reductive pre-treatment of perovskite-type catalysts[J]. Applied Catalysis B:Environmental, 2022, 318:121886.
[40] DU Z, PETRU C, YANG X. Development of stable La0.9Ce0.1NiO3 perovskite catalyst for enhanced photothermochemical dry reforming of methane[J]. Journal of CO2 Utilization, 2023, 67:102317.
[41] 胡久彪,余长林,周晓春.甲烷部分氧化催化剂上的积碳研究进展[J].有色金属科学与工程,2012,3(2):5-11.
HU Jiubiao, YU Changlin, ZHOU Xiaochun. Research progress of carbon deposition on catalysts during the partial oxidation of methane[J]. Nonferrous Metals Science and Engineering, 2012,3(2):5-11.
[42] KIM W Y, JANG J S, RA E C. Reduced perovskite LaNiO3 catalysts modified with Co and Mn for low coke formation in dry reforming of methane[J]. Applied Catalysis a-General, 2019,575:198-203.
[43] LI R J, ZHANG J P, ZHU X. Regulation of metal-support interface of Ni/CeO2 catalyst and the performance of low temperature chemical looping dry reforming of methane[J]. Journal of Fuel Chemistry and Technology, 2022, 50:1458-1470.
Perovsokite-anchored ceria for chemical looping dry reforming

移动阅读