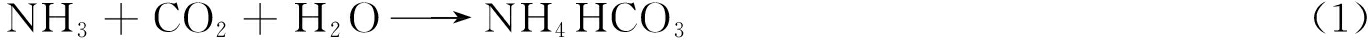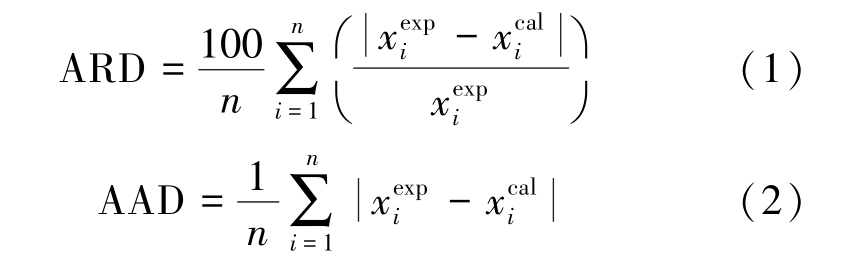重金属-PAHs污染土壤植物微生物修复效果及机理
0 引 言
煤炭作为我国能源行业的支柱性产业,其加工利用过程中存在的环境问题及防护是研究重点。多环芳烃和重金属是焦化行业最典型的特征污染物[1]。在焦化厂、煤化工厂等长期生产过程中,随着大气沉降、固废堆积、降雨淋滤等引起的煤及其加工产物、废物中含有的有害物质发生淋滤或迁移,导致焦化厂、煤气化厂等以煤为主要原料的企业场地或周边土壤中多环芳烃(PAHs)如苯并[a]芘(Benzo[a]pyrene, BaP)、菲(Phenanthrene, Phe)和重(类)金属如砷(As)、铬(Cr)含量高、毒性大、环境风险突出[2-3]。煤化工场地中Pb、As、Cr等重金属及高环PAHs集中分布在土壤表层,浓度随深度增加而减小[4]。
目前,对焦化厂、煤化工厂及其周边土壤的修复研究主要以热解吸、固化/稳定化、化学淋洗等物理化学修复为主[5]。物理化学修复总体效率高、周期短,但多数对土壤生态环境造成不同程度破坏,甚至改变土壤基本形貌,属于典型的高能量密度、高成本修复[6-7]。《“十四五”土壤、地下水和农村生态环境保护规划》指出“土壤污染风险得到基本管控”,在此大背景下“鼓励绿色低碳修复”成为污染土壤修复新技术研发和推广的主导方向[8]。然而,目前针对大量重金属或/和有机污染土壤的修复技术中,植物、微生物及其联合修复技术仅占5%左右,开发绿色低碳污染土壤修复技术及应用体系任重道远。
马溪平等[9]利用植物与微生物对沈抚灌区土壤进行联合修复,土壤重金属污染水平降低的同时有机污染物得到一定程度降解;CHIBUIKE等[10]研究了玉米对Cr和BaP复合污染土壤60 d的修复效果,结果表明复合污染并未影响植物生长,BaP的存在增强了玉米对Cr的吸收和转运,植物的存在增强了高浓度Bap消散;万玉山等[11]对Cd-BaP的复合污染土壤进行修复植物筛选(黑麦草、芥菜、苜蓿和高羊茅)。结果表明,黑麦草对Cd-BaP复合污染土壤中Cd和BaP去除效果良好,75 d后去除率分别达58.55%和89.95%,发现BaP的存在可能会促进黑麦草对Cd的富集。XU等[12]采用植物-微生物联合修复焦化厂污染土壤中的PAHs,植物和微生物共同作用使土壤中PAHs更好地去除。王传花[13]以芘优势降解菌和Cr(VI)还原菌构建混合菌群,联合水蜈蚣修复芘-Cr(VI)复合污染土壤,42 d后芘和Cr(VI)的去除率分别达63.6%和约80%,与空白对照组相比,显著提高了芘和Cr(VI)的去除率。然而,焦化厂、煤化工厂等多种重金属和复杂PAHs共存会多方面抑制微生物、植物等生长发育、功能活性能,其修复效率、修复机理等均与单一污染物或单种重金属与单种PAHs的复合污染土壤相比存在较大差异,有必要针对焦化厂和煤化工厂复杂重金属-PAHs复合污染土壤的植物、微生物修复效果及其机理进行深入探究。
笔者采用植物和微生物共同作用对重金属-PAHs复合污染土壤进行联合修复,探究不同修复措施的效果,耦合污染物去除动态效率、不同形态重金属含量动态变化,微生物酶活性及其群落特性等揭示植物微生物联合修复机理,为焦化厂、煤化工厂等重金属-PAHs复合污染土壤绿色低碳修复提供技术依据和应用基础。
1 试 验
1.1 材料与仪器
供试土壤采自某地农田未污染土,土质为粉壤土,过2 mm筛备用。玉米(禾本科玉蜀黍属一年生草本植物)和黑麦草(禾本科黑麦草属多年生或一年生草本)种子均购于巨丰种业集团有限公司。食醚红球菌(Rhodococcus aetherivorans,BW2)为笔者课题组于焦化厂复合污染土壤中经驯化分离得到的以Phe和Bap为唯一碳源的细菌,经鉴定该菌株与食醚红球菌(Rhodococcus aetherivorans)具有100%的相似度。
环己烷、丙酮、正己烷使用色谱纯,重铬酸钾、七水砷酸氢二钠、十二水合磷酸氢二钠、磷酸二氢钾、丙酮、FDA、三氯甲烷、苯并[a]芘、菲等均使用分析纯,购自麦克林,试验用水均为去离子水。
LS-50HG高压蒸汽灭菌锅,江阴滨江医疗设备有限公司制造;THZ-98AB恒温震荡培养箱,上海一恒科学仪器制造;WFJ 7200分光光度计,尤尼柯仪器有限公司制造;TGL-16M高速离心机,长沙湘仪离心机仪器有限公司制造。
1.2 研究方法
1.2.1 污染土壤的配置
按照Cr6 40 mg/kg、As 60 mg/kg、菲 75 mg/kg、苯并[a]芘 25 mg/kg向采集的土样中加入污染物。使用砷酸氢二钠和重铬酸钾配制混合重金属溶液,使用菲和苯并[a]芘配制混合PAHs丙酮溶液,将配制好的污染物溶液加入未污染土壤中并浸没,搅拌均匀,放置暗处老化15 d后,经测定,加上原始土样背景值,土壤中总Cr和As初始质量分数分别为192.91和84.61 mg/kg,菲和苯并[a]芘的初始质量分数分别为76.83和25.36 mg/kg。盆栽(修复)试验前对土壤进行研磨过筛并再次搅拌均匀。
1.2.2 盆栽试验
前期对修复重金属污染土壤的植物进行筛选试验,结果证明黑麦草和玉米耐受性较好,故选用黑麦草、玉米为修复植物联合食醚红球菌(Rhodococcus aetherivorans,BW2)对配制的污染土壤进行修复。修复试验设计4个试验组,分别为植物 降解菌、仅植物、仅降解菌及未污染土壤种植植物,同时设置污染土壤空白及未污染土壤空白,每组设置3个平行。在需要添加降解菌的试验组中,添加培养至对数期且吸光值OD600调至1的菌悬液100 mL;在需要种植植物的试验组中,每盆装土1 kg并播种15粒黑麦草和4粒玉米种子,发芽稳定后间苗至黑麦草12棵、玉米2棵。修复试验共63 d,温度保持(28±1)℃,光照保持10 h/d,期间定时定量浇水,保持含水率15%,随机改变盆栽位置,并在第7、28和49天对土壤取样测定,第63天时收获植物及土壤。
1.2.3 植物生长的测定
在黑麦草、玉米生长期间,定期对其生长高度进行监测记录。
1.2.4 土壤重金属总量及不同形态含量测定
土壤重金属总量测定:土壤烘干后研磨过筛,取过筛土壤放入消解罐并依次加入5 mL 40% HF、2 mL 65% HNO3和1 mL 30% H2O2作为消解液,通过升温程序进行微波消解[14-15]。微波消解仪的功率均为1 600 W。将消解完的溶液进行赶酸,定容至50 mL。
参考Tiesser连续提取法提取土壤中5种形态的重金属[16],取10 mL不同重金属形态提取液待测。
各待测组使用ICP-MS进行Cr和As浓度测定。ICP-MS工作参数:射频功率1 550 W;雾化室温度2.5 ℃;采样深度5 mm;冷却气流速14 L/min;辅助器流速0.79 L/min;雾化气流速0.99 L/min;蠕动泵速率40 r/min;积分时间0.02 s。
1.2.5 土壤PAHs的测定
将土壤冷冻干燥后过筛,加入替代物(屈-d12,二萘嵌苯-d12)后密封24 h。用体积比1∶1丙酮和正己烷溶液进行索氏提取20 h后脱水并浓缩,采用气相色谱-质谱联用仪(GC/MS)测定16种US EPA优先控制的PAHs含量。色谱柱为30 m×0.25 mm×0.25 μm,DB-5MS。进样口温度290 ℃,无分流进样,GC采用程序升温:初温40 ℃,保持2 min,5 ℃/min升温至290 ℃,保持4 min。载气为氦气,恒流模式,流速为1.00 mL/min,溶剂延迟8 min[17-18]。
1.2.6 污染物降解率的计算
污染物降解率为

(1)
式中,Y为污染物降解率,%;C0为污染物初始质量分数,mg/kg;Ct为第t天的污染物质量分数,mg/kg。
1.2.7 土壤酶活性的测定
采用荧光素二乙酸酯分光光度法测定土壤荧光素双醋酸酯(FDA)酶。采用靛酚蓝比色法测定土壤脲酶活性[19]。采用TTC比色法测定土壤脱氢酶活性[20]。
1.2.8 土壤中微生物群落的测定
采集的土壤样品由北京百迈客生物科技有限公司,使用土壤DNA试剂盒(MN NucleoSpin 96 Soil)提取细菌DNA并扩增后分析。使用PCR扩增法测定微生物群落,对16S V3 V4区域进行扩增,扩增引物为338F(5′- ACTCCTACGGGAGGCAGCA-3′)和806R(5′- GGACTACHVGGGTWTCTAAT-3′)。
使用Mothur软件进行Alpha指数分析(versionv.1.30,(http://www.mothur.org/));基于R语言平台绘制样本主坐标分析及环境因子与样本组成相关性分析。
2 结果与讨论
2.1 植物生长特性
黑麦草和玉米的生长曲线如图1所示,重金属-PAHs复合污染土壤中3个试验组中的黑麦草和玉米均可以正常生长,复合污染并未对2种植物生长造成不利影响 。

图1 黑麦草和玉米的生长曲线
Fig.1 Growth curve of rye grass and maize
由图1可知,2种植物中,空白组(未污染土 植物)植物生长较快,且株高显著高于2组污染组(显著性值p<0.05)。对比联合修复和仅植物修复,黑麦草的株高并无显著差异(p>0.05),而仅植物修复组的玉米株高在修复中期高于联合修复组,在修复后期趋于一致。63 d收获植物后,联合修复组黑麦草株高为空白组黑麦草的0.88倍,玉米为0.82倍,仅植物修复组黑麦草高度为空白组的0.85倍,玉米为0.83倍。
通过研究联合修复、单一植物修复和空白组土壤中重金属浓度研究不同组之间重金属的去除效果,63 d修复期间,土壤中重金属浓度变化如图2所示。由图2可知,土壤中添加Cr和As后的初始质量分数分别为192.91和84.61 mg/kg。空白组Cr和As浓度存在一定波动,但修复土壤中重金属浓度逐渐降低。63 d后,联合修复组土壤中Cr质量分数为174.33 mg/kg,低于仅植物修复组(177.95 mg/kg)及空白组(185.74 mg/kg)。而As浓度在整个修复期间,2组修复组差异不大,联合修复组为80.12 mg/kg,仅植物组为80.86 mg/kg。对比污染土壤空白,不同处理方法下,土壤中Cr去除存在差异,联合修复组土壤中Cr质量分数下降9.63%,As下降5.28%,在单一植物修复组土壤中Cr质量分数下降7.75%,As质量分数下降4.42%。土壤中接种降解菌虽然未提高植物的生物量,但在一定程度上可以提高植物对重金属的吸收[21]。

图2 修复过程中土壤Cr、As浓度变化
Fig.2 Concentration changes in soil Cr and As during the remediation process
2.2 土壤中重金属形态变化
修复过程中Cr在不同试验组的形态变化如图3(a)所示。随修复进行,可交换态和碳酸盐结合态含量逐渐降低,在联合修复组,可交换态含量降低2.79%,碳酸盐结合态降低8.49%;在仅植物修复组中,可交换态降低2.23%,碳酸盐结合态降低6.35%。植物主要吸收土壤中可交换形态的重金属,土壤环境改变后,碳酸盐结合态重金属向可交换态转变从而更易于被植物吸收[22-23]。在仅降解菌修复组,可交换态减少1.55%,碳酸盐结合态减少4.26%。土壤中一些微生物的氧化还原作用可改变土壤中重金属状态,重金属与强离子键结合或与有机质等结合从而形成更难被吸收的铁锰氧化物结合态和有机物结合态[24]。污染土空白组各形态含量基本保持不变。试验用土在未人为添加重金属前即可检测到Cr,说明土壤本身存在残渣态Cr,因其与矿物质等紧密结合而不易被植物提取。

图3 修复过程中土壤Cr和As各形态含量及百分比
Fig.3 Content and percentage of each form of soil Cr and As during the remediation process
黑麦草和玉米对土壤中的As吸收富集能力不及Cr,但植物能在As存在的土壤中正常生长,植物在土壤中的根系分泌物及投入土壤的微生物均会影响土壤中As存在的状态。3个试验组土壤中可交换态As随时间逐渐增加,第63天时,增幅在1.27%~3.13%,土壤中植物和微生物的存在改变了土壤环境,从而改变土壤中重金属不同形态含量。铁锰氧化物结合态As逐渐降低,联合修复组降低1.25%,仅植物组降低1.01%,仅降解菌组保持不变。空白对照组各形态As保持在一个稳定水平。
2.3 土壤中菲和苯并[a]芘的修复效率
黑麦草和玉米对PAHs都有一定降解作用,土壤中加入PAHs降解菌后,将进一步提升土壤中PAHs降解[25]。复合污染土壤修复63 d后,土壤中PAHs浓度变化如图4所示。

图4 修复过程土壤菲、苯并[a]芘浓度
Fig.4 Concentrations of Phe and BaP in soil during remediation process
土壤中菲浓度随时间增加逐渐降低,不同修复组之间菲的去除效果有所不同。经过63 d修复,联合修复组中菲质量分数降至42.15 mg/kg,仅植物组为45.60 mg/kg,仅降解菌组为52.24 mg/kg,空白组土壤中菲也有一定损失,63 d后,质量分数降至54.51 mg/kg。
因苯并[a]芘在土壤中较难去除,本研究中不同修复组之间差异较小。联合修复组、仅植物组、仅降解菌组和空白组第63天时,土壤中苯并[a]芘质量分数分别为18.55、19.03、19.72和21.09 mg/kg。
土壤中的菲在联合修复组降解45.14%,在仅植物组降解40.64%,仅降解菌组降解32.00%,空白组29.05%菲的降低则来自土壤中土著微生物的降解及非生物损失(如光解和挥发)。对比空白组,加入降解菌使菲降解提高2.95%,仅植物试验组对菲的去除高于仅降解菌试验组,在联合修复组中,加入降解菌使菲降解较仅植物组提高4.50%,联合修复组中植物的存在使菲降解较仅降解菌组提高13.14%。苯并[a]芘在土壤中降解较少,经过63 d修复,联合修复组苯并[a]芘降低26.87%,仅植物组降低25.01%,仅降解菌组降低22.26%,空白组降低16.88%。土壤对外源进入的污染物具有一定自净作用,土壤中土著微生物长期受到污染胁迫,能适应变化的环境,对污染的土壤进行一定程度的自净[26]。
2.4 污染土壤修复过程中生物学特性变化
2.4.1 修复过程中土壤酶活性变化
土壤中酶在土壤微环境中具有重要作用,微生物代谢等生化反应离不开酶。对未污染土壤空白及未污染土壤种植物在整个修复期间的FDA水解酶、脲酶和脱氢酶酶活性进行测定,3种酶活性随时间基本保持不变,FDA酶活性较初始有所增加。
未污染土壤中酶活性变化如图5所示,对比未污染空白土壤与未污染种植物土壤,种植物对土壤的酶活性有一定程度提高,但2组之间的酶活性差异不显著。对比未污染土壤酶活性变化,复合污染土壤酶活性变化明显。污染土空白组的3种酶活性随时间增加持续降低,重金属和PAHs使土壤环境不断恶化,继而影响土壤中生理生化反应[27]。较未污染土空白,污染土空白FDA酶活性降低43.75%,脲酶活性降低28.54%,脱氢酶活性降低74.43%,脱氢酶所受抑制最强。

图5 未污染土壤中酶活性变化
Fig.5 Changes in enzyme activity in uncontaminated soil
对比分析联合修复组、仅植物修复组、仅降解菌修复组和污染土空白组的土壤酶活性在整个修复过程中的变化,且不同酶活性在不同处理组之间变化不同,结果如图6所示。

图6 修复过程中土壤FDA酶、脲酶和脱氢酶活性的动态变化
Fig.6 Dynamics of soil FDA enzyme, urease, and dehydrogenase activities during the remediation process
FDA酶活性代表土壤中大多数水解酶的活性,反映土壤中微生物活性,污染土空白组的FDA酶活性随时间增加不断降低,FDA酶活性变化说明土壤中污染物存在使一些酶持续失活,因而降低土壤中微生物活性[28]。整个修复时期,联合修复组的FDA活性高于其他3组。对比仅植物修复和仅降解菌组发现,仅植物修复组随时间增加,FDA酶活性由初期低于仅降解菌组(低7.29%),到后期高于仅降解菌组(高3.59%),说明本研究中植物对土壤中酶的作用大于非土著降解菌的加入。外源降解菌的加入可提高土壤中微生物数量,随土著微生物和降解菌逐渐适应土壤环境改变,FDA酶活性逐渐升高。
土壤中脲酶活性反映土壤中尿素的利用,但脲酶活性受到土壤中污染物的影响。63 d修复过程中,联合修复组脲酶活性逐渐降低,降低13.98%,仅植物组和仅降解菌组变化幅度不大。脱氢酶参与有机物的脱氢反应,具有氢的中间传递体的作用。虽然整体上脱氢酶活性在4个试验组均降低,但联合修复组始终高于另外3组,因此,联合修复组中,PAHs去除率始终高于另外3组。对比仅植物组和仅降解菌组,发现仅植物组的脱氢酶活性高于仅降解菌组,植物对于土壤中脱氢酶活性的提升高于外源添加微生物。
2.4.2 土壤微生物群落结构分析
土壤微生物在分解、养分循环、植物生产力和气候调节方面发挥关键作用。微生物群落结构是土壤微生物的重要方面,群落结构变化与土壤环境改变相关。土壤环境改变促使微生物群落变化,进而影响土壤环境中生化活动,最终表现为土壤质量变化。在测序数据97.0%的相似度水平下进行聚类,获得OTU(Operational Taxonomic Units)。本研究土壤样品中,共获得1 288个不同OTU。以SILVA为参考数据库使用朴素贝叶斯分类器对特征序列进行分类学注释,进而对土壤样品群落组成进行分析,结果如图7所示(CS为未污染土壤;CK0为污染土壤初始;CK、M、P、PM分别为污染土空白组、仅降解菌组、仅植物组、植物-降解菌联合修复组;1、2、3、4分别为取样时间7、28、49、63 d)。

图7 修复过程中土壤微生物的相对丰度(门水平)
Fig.7 Relative abundance of soil microorganisms during restoration (phylum level)
由图7可知,不同修复组变形菌门丰度均先升高后降低,但其所占比例均高于初始和未污染土壤。放线菌门在污染土空白组、仅降解菌组和仅植物组逐渐降低,而在联合修复组保持稳定。Patescibacteria在各处理组初期丰度在10.88%~16.52%,但试验后期降至1.93%~2.55%,DUAN等[29]也发现该菌门在修复后期有所降低。绿湾菌门的丰度逐渐升高,污染土空白组提高8.14%,仅降解菌组提高5.03%,仅植物组提高7.11%,联合修复组提高8.32%。
土壤受到污染后,土壤中微生物最敏感,多样性减少的同时群落发生变化,学者认为多样性减少源于生物体无法在生理上应对压力源,且这些土壤中,污染物的存在对多样性的影响最明显[30]。酸杆菌门分布广泛,土壤受到污染后,其生长受污染物抑制,丰度降低[31-33]。与对照土壤相比,受污染的土壤以变形杆菌为主,而放线菌和酸杆菌(通常在原始土壤中含量丰富)是降解菌群落的次要成分。未受污染的位点具有相似的门水平特征,其中放线菌、变形杆菌和绿湾菌门是存在最丰富的门[30,34-35]。在本研究中也得到类似结果。
对比图7中不同时间点和试验组的群落结构发现,修复时间对群落结构的影响大于不同修复试验组。随时间增加,丰度降低的菌门为放线菌门、Patescibacteria门和厚壁菌门(Firmicutes),分别降低8.71%、11.60%和3.17%,而其余菌门均有不同程度增加。一般来说,有毒污染物会降低正常土壤微生物群的相对丰度,同时迫使具有抗性微生物增加[36]。据报道,变形杆菌含有绝大多数重金属抗性基因,其次是放线菌和拟杆菌[37]。研究指出绿湾菌门的丰度与Cr含量呈正相关,微生物通过抗氧化反应或生物转化而对重金属具有抗性,相对丰度增加,其在重金属生物去除中发挥作用,进而改变微生物群组成[32]。而变形杆菌门和绿湾菌门是含有As代谢基因宿主微生物的显性门[38]。另一个核心门拟杆菌门被发现是蜈蚣草根际中的主要门,且具有减少As(V)的能力[39]。
修复过程中土壤微生物群落结构的主坐标分析如图8所示(CK、M、P、PM分别为污染土空白组、仅降解菌组、仅植物组、植物-降解菌联合修复组)。可知土壤样品微生物群落的主坐标分析图中样品点距离越近,则群落结构越相似。对比不同修复试验组和不同修复时间,对群落结构影响较大的因素是修复时间,这与前述群落丰度结果一致。本研究中群落结构的改变主要受时间驱动,不同生物修复处理组之间差异较小。

图8 修复过程中土壤微生物群落结构的主坐标分析
Fig.8 Principal coordinate analysis of soil microbial community structure during remediation process
2.5 重金属-PAHs复合污染土壤植物微生物联合修复机理
2.5.1 污染物去除率及与土壤酶活性的相关性
土壤中不同污染物去除可能相互影响,其去除或降解离不开酶,将复合污染土壤修复过程中4种污染物去除率之间及其与酶活性进行相关性分析,结果如图9所示(颜色表示正负相关性,红色为正相关,颜色越深,相关性越显著。右上半区数字表示两两之间的相关性系数;左下半区图形表示两两之间的正负相关性及相关性大小,图形越扁、颜色越深表示相关性越强,数字表示显著性水平,小于0.05即为显著(未标出))。

图9 土壤不同污染物去除率及其与酶活性的相关性
Fig.9 Removal rates of different pollutants from soil and their correlation with enzyme activities
由图9可知,FDA酶活性与4种污染物的去除均呈现正相关性,且与苯并[a]芘和As的去除相关性显著。由前文已知土壤中种植植物和接种降解菌后,土壤中FDA酶活性随修复进行逐渐提高,在此处得到印证,一方面土壤中污染物去除减轻了对酶的抑制,另一方面,酶活性提高也促进了污染物去除。与文献报道微生物对污染物胁迫的适应和修复过程中微生物通过群落调节、环境适应等不同策略增加其功能活性较一致[40]。脲酶活性与4种污染物的去除呈正相关性,污染物去除提高了脲酶活性。脱氢酶活性与4种污染物的去除呈显著负相关,土壤中污染物的去除并未提高脱氢酶的活性,说明脱氢酶活性受其他因素影响。
由污染物去除之间的相关性可知(图9),4种污染物去除率之间的相关关系为显著正相关,其中菲降解率和Cr去除率的相关系数达0.91,与本研究前述污染物去除情况一致,相较苯并[a]芘和As,菲和Cr在当前修复体系中更易去除,且去除率高于前者。分析上述原因,多环芳烃的生物降解效率与环数和生物毒性关系密切,如有报道指出菲等3环多环芳烃的微生物降解效率高于苯并[a]芘等5环多环芳烃的同时期降解效率[41-42]。
2.5.2 修复过程中土壤微生物群落冗余分析
将不同环境因子和土壤微生物进行冗余分析以得到环境因子对微生物群落的影响,结果如图10所示(F1~F5为土壤中重金属5个形态,分别为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态;RDA为解释度)。

图10 土壤微生物群落冗余分析
Fig.10 Redundancy analysis of soil microbial communities
可交换态As和碳酸盐结合态As对多数细菌门具有正相关性,且相关性较大。其中拟杆菌门、装甲菌门、FBP菌门和浮霉菌门与可交换态As和碳酸盐结合态As的正相关关系及前述4个菌门与脱氢酶活性的负相关关系印证了土壤中脱氢酶活性在As存在时持续降低的现象。可交换态Cr和碳酸盐结合态Cr对土壤中放线菌门的正相关性较大,影响土壤中放线菌门的丰度。
土壤微生物在生态系统维持中的作用至关重要,其多样化的酶促机制促进了必需的常量/微量营养素的生物地球化学循环,而酶活性对重金属等的存在高度敏感,且这些污染可改变微生物活性,从而改变种群[43]。如果关键酶生产者受其他非酶生产者降解菌物种的刺激或竞争,这些降解菌物种的存在可能通过互利或互斥的降解菌-降解菌相互作用对酶活性产生积极或负面影响;降解菌对土壤中酶的功能具有调节作用,微生物多样性可能提供更大比例的物种,产生一种酶或更多刺激产酶功能的物种,相反,在某些情况下,更大的微生物多样性可能会提供更大比例的物种,而这些物种不产生酶或抑制酶的产生[44]。
2.5.3 重金属-PAHs污染土壤植物微生物联合修复机理
土壤中种植的植物和添加的微生物使土壤中重金属形态发生改变,土壤中可提取态的重金属含量增加,一方面更利于植物对其吸收富集,使重金属从土壤中去除;另一方面,可提取态的重金属生物毒性较高,对土壤中微生物及酶活性产生负面影响。
修复过程中土壤可交换态重金属含量变化如图11所示(a、b、c、d、e代表显著性差异分析,各组间有一个相同字母即为差异不显著,不同字母为差异显著),土壤中可提取态Cr含量降低,说明植物对土壤中Cr的吸收富集提取的是可交换态Cr,虽然土壤中As被吸收富集较少,但生物修复提高了土壤中可交换态As含量[20-21]。而可提取态的As与土壤中一些细菌的菌门丰度表现出一定正相关性,这些细菌与脱氢酶活性呈负相关关系。试验组观察到联合修复组的脱氢酶活性高于仅植物组和仅降解菌组,因而PAHs在联合修复组的降解率高于另外2组。

图11 修复过程中土壤可交换态重金属含量变化
Fig.11 Changes in soil exchangeable heavy metal content during remediation process
综合分析重金属-PAHs复合污染土壤的植物微生物联合修复机理可知,土壤中投加高效降解菌在一定程度上可提高植物对重金属的吸收;植物和微生物是对土壤中不同污染物起作用的主体,重金属的去除主要依赖植物,而PAHs的去除则很大程度取决于微生物及其与植物的相互作用。在重金属-PAHs复合污染土壤的植物微生物联合修复过程中,不同类型污染物去除效率之间存在明显正相关关系,同时综合修复效率受酶活性和不同功能微生物丰度的动态影响,反之土壤微生物群落结构和功能也会受土壤中污染物种类、浓度及理化性质等综合作用发生一定改变,即植物微生物联合修复可调节土壤微生态环境,使土壤环境在一定程度上完善并向有利于生物生长发育或风险降低的方向改变,是一种可持续的绿色低碳修复技术。
3 结 论
1)通过黑麦草-玉米-Rhodococcus aetherivorans联合修复,63 d后土壤中Cr、As、菲、苯并[a]芘质量分数分别下降9.63%、5.28%、45.14%、26.87%。其中重金属的去除主要依赖植物,PAHs的去除在很大程度上取决于微生物及其与植物的相互作用。
2)植物主要吸收可提取态重金属,63 d后不同修复组土壤中可交换态Cr平均下降2.19%;由于植物对As的富集较少,降解菌的投加影响土壤中As形态变化,增加土壤中可交换态As,导致各修复组土壤中可交换态As随时间增长逐渐增加,63 d增幅在1.27%~3.13%。
3)植物和降解菌可提高土壤中FDA、脲酶和脱氢酶活性,FDA、脲酶活性均与4种污染物的去除呈正相关(p<0.05),脱氢酶活性与4种污染物的去除呈显著负相关(p<0.05);可交换态Cr和碳酸盐结合态Cr与土壤中放线菌门为强正相关,可交换态As和碳酸盐结合态As则与拟杆菌门、装甲菌门、FBP菌门和浮霉菌门呈正相关。
4)作为重金属-PAHs复合污染土壤联合修复的功能主体,重金属的去除主要依赖植物,PAHs的去除则很大程度上取决于微生物及其与植物的相互作用。在重金属-PAHs复合污染土壤的植物微生物联合修复过程中,污染物去除效率之间存在明显相互作用,同时受酶活性和不同功能微生物丰度的动态影响,反之土壤微生物群落结构和功能也受土壤中污染物种类、浓度及理化性质等综合作用,发生一定改变。
[1] 王耀锋,何连生,姜登岭,等. 我国焦化场地多环芳烃和重金属分布情况及生态风险评价[J]. 环境科学, 2021, 42(12): 5938-5948.
WANG Yaofeng, HE Liansheng, JIANG Denglin, et al. Distribution and ecological risk assessment of polycyclic aromatic hydrocarbons and heavy metals in coking sites in China[J]. Environmental Science, 2021, 42(12): 5938-5948.
[2] 张亦弛,于玲红,王培俊,等. 某焦化生产场地典型污染物的垂向分布特征[J]. 煤炭学报, 2012, 37(7): 1211-1218.
ZHANG Yichi, YU Linghong, WANG Junpei, et al. Vertical distribution of typical contaminants at a coking plant site,China[J]. Journal of China Coal Society, 2012, 37(7): 1211-1218.
[3] 章丽萍,刘青,崔炜,等. 煤焦化固体残渣污染特性研究[J]. 洁净煤技术, 2015,21(5): 110-114.
ZHANG Liping,LIU Qing,CUI Wei, et al. Pollution characteristics of residues from coal coking process[J]. Clean Coal Technology, 2015,21(5): 110-114.
[4] 桑康云,张可能,吴霞,等. 某焦化场地重金属与多环芳烃复合污染特征与评价[J]. 环境化学, 2023, 42(5): 1651-1662.
SANG Kangyun, ZHANG Keneng, WU Xia, et al. Co-contaminated characteristics and assessment of heavy metal and polycyclic aromatic hydrocarbons in a coking site [J]. Environmental Chemistry, 2023, 42(5): 1651-1662.
[5] 周玉璇,龙涛,祝欣,等. 重金属与多环芳烃复合污染土壤的分布特征及修复技术研究进展[J]. 生态与农村环境学报, 2019, 35(8): 964-975.
ZHOU Yuxuan, LONG Tao, ZHU Xin, et al. Research progress on distribution and remediation technologies for the combined pollution of heavy metals and polycyclic aromatic hydrocarbons in soil [J]. Journal of Ecology and Rural Environment, 2019, 35(8): 964-975.
[6] 骆永明. 污染土壤修复技术研究现状与趋势[J]. 化学进展, 2009, 21(2): 558-565.
LUO Yongming. Current research and development in soil remediation technologies [J]. Progress in Chemistry, 2009, 21(2): 558-565.
[7] 李婉怡,於维维,余琼阳,等. 土壤重金属-有机物复合污染环境效应与修复技术研究进展[J]. 土壤, 2023, 55(3): 453-463.
LI Wanyi, YU Weiwei, YU Qiongyang, et al. Environmental effects and remediation technologies of heavy metal-organic pollutant co-contaminated soil: A review [J]. Soils, 2023, 55(3): 453-463.
[8] 生态环境部,发展改革委,财政部,等. 《“十四五”土壤、地下水和农村生态环境保护规划》[EB/OL].(2021-12-31)[2023-11-20]. https://www.mee.gov.cn/xxgk2018/xxgk/xxgk03/202112/t20211231_965900.html.
[9] 马溪平,付保荣,李法云,等. 植物-微生物联合修复污染土壤的研究[J]. 中国公共卫生, 2005, 21(5): 572-573.
MA Xiping, FU Baorong, LI Fayun, et al. Study of plant-microorganism combined bioremediation on contaminated soil [J]. Chinese Journal of Public Health, 2005, 21(5): 572-573.
[10] CHIBUIKE Chigbo, LESLEY Batty. Phytoremediation for co-contaminated soils of chromium and benzo[a]pyrene using Zea mays L[J]. Environmental Science &Pollution Research, 2014, 21(4): 3051-3059.
[11] 万玉山,陈艳秋,吕浩,等. 植物对Cd-B[α]P复合污染土壤的修复[J]. 环境工程学报, 2017, 11(6): 3866-3872.
WAN Yushan, CHEN Yanqiu, LYU Hao, et al. Phytoremediation of Cd-B[α]P compound contaminated soil [J]. Chinese Journal of Environmental Engineering, 2017, 11(6): 3866-3872.
[12] XU Congbin , YANG Wenjie, WEI Lianshuang, et al. Enhanced phytoremediation of PAHs-contaminated soil from an industrial relocation site by Ochrobactrum sp[J]. Environmental Science and Pollution Research, 2020, 27(9): 8991-8999.
[13] 王传花. 固定化菌群联合水蜈蚣修复芘—铬复合污染土壤实验研究[D]. 上海: 上海大学, 2016: 73-74.
[14] ARULPOOMALAI Ayyanar, THATIKONDA Shashidhar. Distribution and ecological risks of heavy metals in Lake Hussain Sagar, India[J]. Acta Geochimica, 2020, 39(2): 255-270.
[15] MAR A Del Refugio Castaeda-Chávez,FABIOLA Lango-Re-ynoso, GABYCARMEN Navarrete-Rodríguez. Study on contamination by heavy metals in the cotaxtla-jamapa basin with influence in the central zone of the gulf of mexico[J]. Water Air and Soil Pollution, 2020, 231(3): 1-13.
A Del Refugio Castaeda-Chávez,FABIOLA Lango-Re-ynoso, GABYCARMEN Navarrete-Rodríguez. Study on contamination by heavy metals in the cotaxtla-jamapa basin with influence in the central zone of the gulf of mexico[J]. Water Air and Soil Pollution, 2020, 231(3): 1-13.
[16] TESSIERA , CAMPBELL P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851.
[17] HAN Xuemei, LIU Yurong, ZHANG Limei, et al. Insight into the modulation of dissolved organic matter on microbial remediation of PAH-contaminated soils[J]. Microbial Ecology, 2015, 70(2): 400-410.
[18] MOHAMED M Mahfouz, HASSAN M, ELOBAID Elnaiem A, et al. PAH concentrations and exposure assessment from house dust retained in air-conditioning filters collected from Greater Doha, Qatar[J]. Environmental Geochemistry and Health, 2019, 41(5): 2251-2263.
[19] 关松荫. 土壤酶及其研究法[M]. 北京: 北京农业出版社, 1986: 296-297.
[20] 汪杏,沈根祥,胡双庆,等. 铬(Ⅵ)和菲单一及复合污染对土壤微生物酶活性的影响[J]. 农业环境科学学报, 2016, 35(7): 1300-1307.
WANG Xing, SHEN Genxiang, HU Shuangqing, et al. Effects of single and joint pollution of chromium(Ⅵ)and phenanthrene on microbiological enzyme activities in soil [J]. Journal of Agro-Environment Science, 2016, 35(7): 1300-1307.
[21] 张珣,陈宝楠,孙丽娜. 植物-微生物联合修复佳乐麝香与镉复合污染土壤的研究[J]. 沈阳农业大学学报, 2016, 47(2): 166-172.
ZHANG Xun, CHEN Baonan, SUN Linna. Remediation of galaxolide and cadmium compound contaminated soil with plant-microbial combination [J]. Journal of Shenyang Agricultural University, 2016, 47(2): 166-172.
[22] XIAN X.Effect of chemical forms of cadmium, zinc, and lead in polluted soils on their uptake by cabbage plants[J]. Plant and Soil, 1989, 113(2): 257-264.
[23] MEHDI Bahrami, JAHANTAB Esfandiar, MAHMOUDI Mohammad-Reza. Clustering the organic soil amendments in combination with phytoremediation of heavy metals contaminated soil[J]. International Journal of Environmental Analytical Chemistry, 2021, 18:6742-6756.
[24] 徐粲然,卢滇楠,刘永民. 生物钝化修复镉污染土壤研究进展[J]. 化工进展, 2014, 33(8): 2174-2179.
XU Canran, LU Diannan, LIU Yongmin. Research advance in the biostabilization remediation of cadmium contaminated soil[J]. Chemical Industry and Engineering Progress, 2014, 33(8): 2174-2179.
[25] HU Xiaoxin, ZHANG Xinying, LIU Xiaoyan, et al. The contribution of pyrene degrading bacteria and chemical reagents to scirpus triqueter phytoremediation of pyrene and Ni co-contaminated soil[J]. Water Air and Soil Pollution, 2017, 228(8): 295.
[26] 张超兰,徐建民,姚斌. 阿特拉津污染胁迫下土壤微生物生物量对外源有机无机物质的响应[J]. 土壤学报, 2004, 41(2): 323-326.
ZHANG Chaolan, XU Jianmin, YAO Bin. The response of soil microbial biomass to organic amendments and fertilizers under atrazine stress[J]. Acta Pedologica Sinica, 2017, 228(8): 295.
[27] 韩文辉,党晋华,赵颖. 污灌区重金属和多环芳烃复合污染及其对农田土壤微生物数量的影响[J]. 生态环境学报, 2016, 25(9): 1562-1568.
HAN Wenhui, DANG Jinhua, ZHAO Ying. Compound pollution of heavy metals and polycyclic aromatic hydrocarbons in sewage irrigation area and its effect on soil microbial quantity[J]. Ecology and Environmental Sciences, 2016, 25(9): 1562-1568.
[28] 邢奕,张莹莹,司艳晓,等. 铁矿区重金属污染对土壤微生物代谢活性的影响[J]. 环境科学研究, 2015, 28(12): 1879-1886.
XING Yi, ZHANG Yingying, SI Yanxiao, et al. Impacts of long-term heavy metal pollution on microbial metabolic activity in iron mine soil[J]. Research of Environmental Sciences, 2015, 28(12): 1879-1886.
[29] Duan Renyan, Lin Yuxiang, Zhang Jianing, et al. Changes in diversity and composition of rhizosphere bacterial community during natural restoration stages in antimony mine[J]. PeerJ, 2021, 9(10): E12302.
[30] SHEIK Cody S, MITCHELL Tyler W, RIZVI Fariha Z, et al. Exposure of soil microbial communities to chromium and arsenic alters their diversity and structure[J]. Plos One, 2012, 7(6): E40059.
[31] TEIXEIRA Lia C R S , PEIXOTO Raquel S, CURY Juliano C, et al. Bacterial diversity in rhizosphere soil from Antarctic vascular plants of Admiralty Bay, maritime Antarctica[J]. The ISME Journal, 2010, 4(8): 989-1001.
[32] JONES Ryan T , ROBESON Michael S, LAUBER Christian L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. The ISME Journal, 2009, 3(4): 442-453.
[33] SIPIL Timo P , KESKINEN Anna Kaisa, KERMAN Marja Lee-na, et al. High aromatic ring-cleavage diversity in birch rhizosphere: PAH treatment-specific changes of I.E.3 group extradiol dioxygenases and 16S rRNA bacterial communities in soil[J]. Isme Journal, 2008, 2(9): 968-981.
[34] YOUSSEF Noha H, ELSHAHED Mostafa S. Diversity rankings among bacterial lineages in soil[J]. Isme Journal, 2009, 3(3): 305-313.
[35] SHEIK C S, BEASLEY W H, ELSHAHED M S, et al. Effect of warming and drought on grassland microbial communities[J]. Isme Journal, 2011, 5(10): 1692-1700.
[36] XU Yilu, SESHADRI Balaji, SARKAR Binoy, et al. Biochar mo-dulates heavy metal toxicity and improves microbial carbon use efficiency in soil[J]. Science of the Total Environment, 2018, 621(5): 148-159.
[37] YAN Changchun, WANG Fei, GENG Huanhuan, et al. Integrating high-throughput sequencing and metagenome analysis to reveal the characteristic and resistance mechanism of microbial community in metal contaminated sediments[J]. Science of the Total Environment, 2020, 707:136116.
[38] LI Xianhong, LIU Xiaoxia, CAO Neng, et al. Adaptation mechanisms of arsenic metabolism genes and their host microorganisms in soils with different arsenic contamination levels around abandoned gold tailings[J]. Environmental Pollution, 2021, 291(10): 117994.
[39] HAN Yonghe,JIA Mengru,LIU Xue, et al. Bacteria from the rhizosphere and tissues of As-hyperaccumulator Pteris vittata and their role in arsenic transformation[J]. Chemosphere, 2017, 186:599-606.
[40] ZHANG Beng, XU Wei, MA YiChi, et al. Effects of bioaugmentation by isolated Achromobacter xylosoxidans BP1 on PAHs degradation and microbial community in contaminated soil[J]. Journal of Environmental Management, 2023, 334:117491.
[41] 吴洁婷,许琪,张营. 微生物降解典型高分子量多环芳烃的研究进展[J]. 环境科学研究, 2021, 34(8): 1981-1990.
WU Jieting, XU Qi, ZHANG Ying. Progress inmicrobial degradation of typical HMW-PAHs[J]. Research of Environmental Sciences, 2021, 34(8): 1981-1990.
[42] 杜志德,戴叶亮,李艳洁,等. 糙皮侧耳和鞘脂菌NS7对多环芳烃污染土壤的生物强化与协同作用[J]. 微生物学通报, 2021, 48(12): 4530-4540.
DU Zhide, DAI Yeliang, LI Yanjie, et al. Bioaugmentation of polycyclic aromatic hydrocarbons contaminated soil with Pleurotus ostreatus and Sphingobium sp. NS7 and their synergistic effect[J]. Microbiology China, 2021, 48(12): 4530-4540.
[43] PARUL Chaudhary, SHARMA Anita, CHAUDHARY Anuj, et al. Illumina based high throughput analysis of microbial diversity of maize rhizosphere treated with nanocompounds and Bacillus sp[J]. Applied Soil Ecology, 2021, 159:103836.
[44] LUO X,YANG Y,WANG L,et al. Relations between bacterial communities and enzyme functions of two paddy soils[J]. European Journal of Soil Science, 2018, 69(4): 655-665.
Efficiency and mechanism of plant-microbial remediation for heavy metals and polycyclic aromatic hydrocarbons contaminated soils
JIA Jianli,GAO Xiaolong,ZHANG Ben,et al.Efficiency and mechanism of plant-microbial remediation for heavy metals and polycyclic aromatic hydrocarbons contaminated soils[J].Clean Coal Technology,2024,30(1):205-216.

移动阅读