Mo2C/Cu共负载TiO2光催化CO2还原性能
0 引 言
化石燃料大量使用引发一系列环境问题。世界温室气体排放不断增加[1],CO2等温室气体大量排放导致全球变暖、海平面上升等一系列气候问题,将CO2转化为人类可利用的能源具有重要意义[2]。光能驱动CO2还原可在较温和条件下将CO2还原为CO、CH4、HCOOH等碳氢化合物,具有成本低、能耗低等优点。TiO2是一种常用半导体材料[3],被广泛应用于光催化CO2还原研究。然而,由于TiO2对可见光吸收少、光生电子与空穴对复合严重等问题,导致其光催化反应活性很低。贵金属助催化剂如Pt[4-5]、Pd[6]、Ru[7]、Au[8-9]、Ag[10]等被广泛用于TiO2改性,不仅可减小TiO2带隙宽度,显著抑制光生电子与空穴对的复合,还可为CO2光催化还原提供高活性反应位点。但这类贵金属材料由于价格昂贵、成本高等因素限制了其大规模使用。碳化钼[11]是C原子渗入过渡金属元素Mo晶格中,形成类似固溶体的间充化合物。C原子的引入修饰了母体金属Mo的d带,导致碳化钼在费米能级处具有丰富的态密度,从而使其具有类贵金属[12-13]的性质。这类材料因具有与贵金属相似的电子结构和催化活性、制备过程简单、成本低等优点受到关注。YUE等[14]制备了Mo2C-TiO2异质结纳米结构,这种特殊结构使光解水产氢量达39.4 mmol/(h·g),为普通TiO2的25倍。LIU等[15]使用硫磺对钼酸铵及三聚氰胺为原料制备的碳化钼进行硫化,制备了MoS2-Mo2C@C/TiO2催化剂用于光解水制氢研究。研究发现,MoS2-Mo2C@C异质结的催化活性高于Mo2C@C及MoS2@C,其中MoS2由于其不饱和钼的存在,可有效促进H 吸附从而提高反应活性。LI等[16]通过程序升温法制备了Mo2C/TiO2催化剂,发现紫外光条件下0.54% Mo2C/TiO2与0.54% Pt/TiO2对苯酚降解具有相近活性。LIU等[17]制备了Pt-Mo2C/TiO2 NTAs电极用于减少贵金属Pt负载,归因于Pt和Mo2C协同作用及NTAs比表面积大,其HER催化活性为商用Pt/C电极的8倍。GAO等[18]以偏钨酸铵、钼酸铵及三聚氰胺为原料制备了WC-Mo2C@C异质结纳米颗粒用于提高TiO2光解水产氢的活性,WC的引入可提高光催化剂的电导率并削弱Mo2C的Mo—H键,其产氢活性为纯TiO2的90.3倍。
综上所述,碳化钼被认为是未来Pt催化剂的替代品[19],在光解水制氢[20-21]、甲烷二氧化碳重整[22-23]等催化反应中得到广泛应用并具有优异的催化性能,但其在光催化还原CO2研究很少。前人研究发现[4,24],Pt-Cu/TiO2中Cu可提高光催化CO2还原产物CH4的选择性;Cu元素在光解水制氢反应[21]中相比其他过渡金属元素具有更高活性。因此,笔者以三氧化钼及尿素为原料制备了Mo2C材料,研究其对光催化CO2还原产物CH4、CO及H2产量的影响;进一步在Mo2C中引入Cu元素,探究其对光催化CO2还原产物选择性的影响,初步揭示了光催化反应的机理。
1 试 验
1.1 Mo2C和Mo2C-Cu的制备
通过高温焙烧制备Mo2C、Mo2C-Cu催化剂[21,25-27]:将0.5 g MoO3粉末及2 g尿素按质量比1∶4 放入研钵中充分研磨,将混合均匀的粉末置于管式炉中,在600 ℃、Ar气氛下焙烧5 h即得到β-Mo2C,升温速率为5 ℃/min;再将0.5 g MoO3及一定质量CuCl2溶于5 mL去离子水中,并将混合溶液在60 ℃下超声蒸干溶剂使其混合均匀,按照与制备β-Mo2C相同的方式加入2 g尿素,混合均匀后焙烧,即得到Mo2C-Cu。
1.2 Mo2C/TiO2和Mo2C-Cu/TiO2的制备
通过超声将Mo2C、Mo2C-Cu负载至TiO2表面,其中TiO2为纳米二氧化钛(阿拉丁,CAS:13463-67-7)。将一定质量Mo2C或Mo2C-Cu加入溶有TiO2的乙醇溶液中并超声处理0.5 h,再将混合物放入60 ℃真空干燥箱中干燥4 h,最后将干燥后催化剂研磨至粒径0.25 mm以下备用。
1.3 光催化剂的表征
采用X射线衍射分析(XRD)分析催化剂的晶型结构、物相组成等,扫描角度为5°~80°,扫描步长为8(°)/min;采用比表面积及孔径分析仪测定催化剂的比表面积、孔径和孔容等;X射线光电子能谱(XPS)测定了材料表面元素的化学价态;XPS价带谱测定了固体材料价带的位置;紫外及可见光吸收光谱(UV-Vis)测定了催化剂对不同波长光的响应特性;采用F7000荧光光谱仪记录了催化剂的光致发光光谱(PL)谱,分析材料中光生电子与空穴的复合,激发光源波长为325 nm;采用化学吸附仪(CO2-TPD)测定了材料在30~800 ℃的CO2程序升温脱附峰;利用电化学工作站(上海辰华760e)测定了材料的光电化学性质,工作电极、对电极和参比电极分别为FTO导电玻璃、Pt电极和Ag/AgCl电极,电解质溶液为0.2 mol/L的Na2SO4水溶液;其中电化学阻抗谱(EIS)测试频率为0.01~100 000.00 Hz,莫特-肖特基曲线(Mott-Schottky plots)分别在1 000、1 500 Hz两个频率下测试。
1.4 光催化CO2还原反应系统
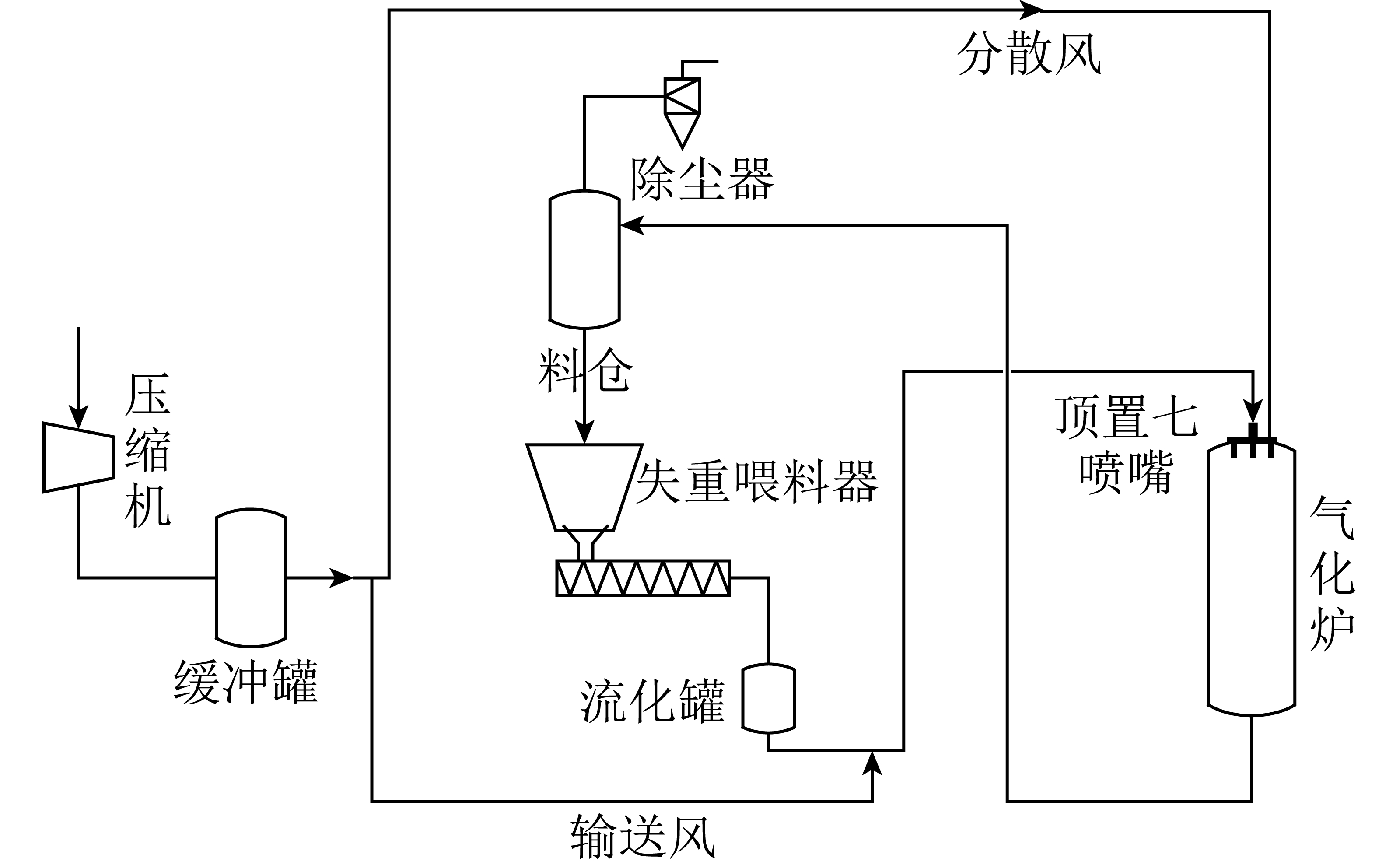
光催化CO2还原反应在石英反应器中进行。该反应系统主要由石英反应器、水蒸气发生装置、紫外灯(9 W,365 nm)及气相色谱(GC7900)组成(图1)。其中,紫外灯放置于反应器顶部,催化剂(0.2 g)均匀分散在石英反应器内,去离子水(10%甲醇)由高压液相泵注入气化炉中汽化。试验过程中,水蒸气由高纯CO2气体(15 mL/min)带入光催化反应器中,利用气相色谱检测反应4 h后尾气中CH4、CO及H2体积分数。反应温度为105 ℃,高压液相泵流量为0.01 mL/min(蒸汽含量为此温度下的饱和水分含量)。

图1 光催化试验装置
Fig.1 Photocatalysis experimental device
2 结果与讨论
2.1 催化剂的结构与形貌
通过尿素还原法制备了β-Mo2C,探究了不同尿素加入量对碳化产物的影响如图2所示。由图2(a)可知,MoO3与尿素质量比为1∶1时,碳化产物为MoO2和Mo9O26的混合物;MoO3与尿素质量比为1∶4时,对比PDF标准卡片(JCPDS No.35-0787)碳化产物为β-Mo2C,说明碳化钼制备成功;MoO3与尿素质量比为1∶8时,碳化产物变为MoO2与MoN混合物;MoO3与尿素质量比为1∶12时,碳化产物中MoN峰更明显,说明MoO2可能转化成MoN。由图2(b)可知,随原料中CuCl2配比(质量比)增加,Cu特征峰(JCPDS No.04-0836)更明显,说明不同含量Cu被负载在Mo2C材料上,MoO3和CuCl2配比分别命名为3MoO3- 0.15CuCl2、3MoO3-0.30CuCl2、3MoO3-0.45CuCl2、3MoO3-0.60CuCl2和3MoO3-0.90CuCl2。将以上不同MoO3和CuCl2配比的碳化产物分别命名为3Mo2C-0.15Cu、3Mo2C-0.30Cu、3Mo2C-0.45Cu、3Mo2C-0.60Cu和3Mo2C -0.90Cu。

图2 Mo2C和Mo2C-Cu的XRD谱图
Fig.2 XRD patterns of Mo2C and Mo2C-Cu
TiO2、3% Mo2C/TiO2、3% 3Mo2C-0.60Cu/TiO2的XRD谱图如图3所示,可知3种材料中只观察到锐钛矿型TiO2的特征峰(JCPDS No.21-1272),并未观察到Mo2C及Mo2C-Cu特征峰,可能是由于其负载量低或分散度较高。

图3 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的XRD谱图
Fig.3 XRD patterns of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
TiO2、3% Mo2C/TiO2、3% 3Mo2C-0.60Cu/TiO2的N2吸/脱附曲线及BJH孔径分布如图4所示,可知所有样品均为第IV型吸附曲线;从脱附曲线看,上述材料孔结构可能是纳米二氧化钛堆积而形成的锥形狭缝孔。此外在低压区吸附量迅速增加是由于少量微孔被填充。另外从低压区单分子层吸附段看,上述材料的微孔很少。从BJH孔径分布可知,纯TiO2的孔径分布范围较大,介孔数量较多。引入Mo2C后催化剂孔径分布范围变窄;引入Cu后催化剂孔径分布无明显变化,只是进一步减少了此范围内孔的数量。

图4 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的N2吸/脱附曲线和孔径分布
Fig.4 N2 adsorption/desorption curves and pore size distribution of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的结构性质见表1(SBET、Vt和Dave分别为样品的比表面积、孔容和平均孔径),可知随Mo2C和Cu负载增加,催化剂的比表面积、孔容不断降低,这可能是由于助催化剂负载堵塞了TiO2的部分孔道结构。
表1 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的结构性质
Table 1 Structural properties of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts

为确定催化剂表面各元素的化学价态及各组分之间的相互作用,利用XPS对TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2进行分析表征如图5所示。由图5(a)、5(b)可知,这3个样品中晶格氧(Ti—O—Ti)峰结合能均为529.9 eV,除晶格氧外,另一个明显的O 1s峰为表面羟基氧[28](Ti—OH)峰,其结合能为532.0 eV。Mo2C和Cu负载后,O 1s结合能的位置并未明显偏移且表面羟基氧和晶格氧比例未发生较明显变化。说明催化剂表面羟基氧含量不是影响光催化活性的关键因素。由图5(c)可知,所有样品Ti 2p的结合能区均存在2个峰,根据结合能位置看所有样品中Ti都以Ti4 形式存在。纯TiO2中Ti 2p3/2的结合能[29-30]为459.0 eV,3% Mo2C/TiO2中Ti峰向高结合能方向发生偏移。引入Cu后,Ti峰进一步向高结合能方向偏移。这可能是由于助催化剂Mo2C、Cu和TiO2载体发生了金属-载体强相互作用,导致电子从TiO2向Mo2C及Cu迁移。
由图5(d)、5(e)可知,纯Mo2C中Mo2 、Mo4 和Mo6 的结合能[31-33]分别为229.3、230.8和233.1 eV,其中Mo2 、Mo4 和Mo6 可归属为Mo2C、
MoO2和MoO3中Mo的化学价态,在Mo2C-Cu材料中Mo 3d峰相比纯Mo2C向高结合能方向发生偏移。Mo4 和Mo6 峰的存在说明Mo2C在空气中发生表面氧化。Mo2C沉积到TiO2表面后,Mo 3d峰向低结合能方向发生明显偏移,这可能是Mo2C具有捕获电子能力,吸引Ti电子。而Cu沉积后Mo 3d结合能向高结合能方向偏移,这说明电荷由Mo向Cu发生迁移,提高了Cu颗粒上的电子密度。在纯铜中Cu0、Cu 和Cu2 的2p3/2结合能[34-36]位置分别为932.6 、932.7和934.8 eV。
由图5(f)可知,催化剂表面Cu价态可能为Cu0和Cu2 ,且相比纯Cu向低结合能方向有一定偏移,Cu2 的出现可能是由于Cu在空气中发生氧化。图5(g)中是3% 3Mo2C-0.60Cu/TiO2样品中Cu 2p轨道的高分辨谱。由图5(g)可知,Cu共沉积后,Cu 2p峰向低结合能方向偏移,说明电荷由Mo向Cu发生迁移,提高了Cu颗粒的电子密度。为进一步确定催化剂表面Cu元素价态,测试了Cu的俄歇电子能谱(图5(h)),其中Cu0、Cu 和Cu2 俄歇电子结合能[37]为568.0、570.4和568.5 eV。从俄歇电子能谱非线性拟合结果可确定,Cu价态为Cu0和Cu2 。结合XRD测试结果,Cu0是催化剂表面的主要物种,而Cu2 可能是催化剂暴露于空气中被氧化导致。
TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2的透射电镜照片如图6~8所示。可知TiO2颗粒分布均匀,平均粒径在20 nm左右(图6(c))。引入Mo2C、Cu后,TiO2颗粒粒径无明显变化(图7(a)、图8(a))。图7(b)和图8(b)可知,TiO2表面的Mo2C和Mo2C-Cu颗粒发生较严重团聚[21]。由图7(c)、8(c)可知,Mo2C和Cu纳米颗粒特征的晶格条纹间距分别为0.228和0.181 nm,与Mo2C的(111)晶面及Cu的(200)晶面相对应。

图5 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的XPS谱图
Fig.5 XPS spectra of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
采用EDS mapping分别分析了3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2催化剂表面Mo、C及Mo、C和Cu的元素分布,如图9所示。可知Mo、C、Cu元素均匀分布在TiO2表面。

图6 TiO2的TEM图像
Fig.6 TEM images of TiO2

图7 3% Mo2C/TiO2的TEM及HRTEM图像
Fig.7 TEM and HRTEM images of 3% Mo2C/TiO2

图8 3% 3Mo2C-0.60Cu/TiO2的TEM及HRTEM图像
Fig.8 TEM and HRTEM images of 3% 3Mo2C-0.60Cu/TiO2

图9 3% Mo2C/TiO2和3% 3Mo2C-0.60Cu/TiO2的EDS mapping
Fig.9 EDS mapping of 3% Mo2C /TiO2 and 3% 3Mo2C-0.60Cu/TiO2
2.2 光催化CO2还原性能评价
进行系列对照试验:① 加入催化剂,但不打开紫外灯;② 打开紫外灯,但不加入催化剂;③ 关闭紫外灯,也不加入催化剂。这3种情况下,尾气中均未检测到任何含碳产物。这表明在没有光源及催化剂条件下,光催化反应均无法进行。其次,打开紫外灯并加入催化剂时,使用Ar气替代CO2进行光催化试验,并未观察到CO、CH4产生。说明试验得到的反应产物均来自高纯CO2。高纯CO2气体和水蒸气在催化剂作用下,经4 h紫外光照射后,主要气相产物为CH4、CO和H2。

图10 Mo2C/TiO2和Mo2C-Cu/TiO2催化剂的H2、CO及CH4累计产量
Fig.10 Cumulative yields of H2,CO and CH4 for Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
Mo2C/TiO2和Mo2C-Cu/TiO2催化剂的H2、CO及CH4累计产量如图10所示,纯TiO2由于产生较少光生电子和严重光生载流子复合,反应活性较低,CH4、CO和H2累计产量分别为13.6、16.0和70.2 μmol/g。CH4和H2累计产量随Mo2C负载量的增加而先增加后降低。
由图10(a)可知,Mo2C负载量为3%时,CH4和H2产量最高,分别为60.5和165.1 μmol/g,分别为纯TiO2活性的4.4倍和2.4倍。3% Mo2C/TiO2样品比纯TiO2的CO累计产量稍高,说明Mo2C的负载对CO产量也有促进作用。结果表明,在3% Mo2C/TiO2催化作用下,CH4累计产量高于CO。一般认为光催化反应过程是热力学和动力学(电荷传输)之间的竞争过程[38],反应过程中存在足够多电荷时(Mo2C可捕获光生电子),反应热力学起主导作用,而CH4(还原电极电势相对于饱和甘汞电极Ered/SCE=-0.48 eV)的生成在热力学上比CO(Ered/SCE = -0.77 eV)更可行,导致CH4累计产量高于CO。
Mo2C、Cu共同负载至TiO2表面不仅可提高光生电子对CO2还原的选择性(抑制H2产生),还可提高产物CH4的选择性(图10(b))。负载量均为3%时,3Mo2C-0.60Cu/TiO2催化剂活性最高,CH4累计产量为76.1 μmol/g,为纯TiO2活性的5.6倍,且H2受到较明显抑制。
不同催化剂产物选择性对比如图11所示,可知Mo2C和Cu共负载的催化剂,CH4累积产量进一步提高。这可能是由于Cu的负载可进一步捕获光生电子[39],反应过程中存在充足电荷时在热力学上CH4产生比CO更容易。由图11可知,3% 3Mo2C-0.60Cu/TiO2催化剂经过5次重复使用后活性并未明显降低。
采用CO2程序升温脱附试验研究TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2化学吸附特性,如图12所示。TiO2的CO2脱附位置主要发生在较低温度300 ℃附近,这说明CO2在纯TiO2表面吸附较弱;Mo2C负载后,CO2脱附峰向高温方向390 ℃发生偏移,这说明Mo2C有利于CO2吸附;Mo2C、Cu共负载时,在更高温度(428、592 ℃)出现CO2脱附峰,这可能是由于铜氧化物呈碱性,导致催化剂与CO2结合更紧密产生了更强的化学吸附。一般认为,CO2和H2O在催化剂表面发生竞争吸附[38],Cu的负载有利于CO2吸附从而抑制H2O吸附,导致H2产量降低。
2.3 光催化剂的光电化学性质表征
催化剂样品的紫外及可见光吸收光谱(UV-Vis)如图13所示,纯TiO2的吸收边在390 nm附近,对可见光吸收很低。由图13(a)、13(b)可知,引入Mo2C、Cu后,催化剂在可见光及紫外光区域吸光度明显增强,说明其具有更好的光捕获能力。运用光学带隙和吸光度之间关系式计算了TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2三个样品带隙宽度:

图11 不同催化剂产物选择性对比及Mo2C-Cu/TiO2催化剂循环稳定性评价
Fig.11 Comparison chart of selectivity of different catalyst products and cyclic stability evaluation of Mo2C-Cu/TiO2 catalyst

图12 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的CO2-TPD图谱
Fig.12 CO2-TPD spectra of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
(Ahν)n = k(hν-Eg)。
(1)
其中,A为吸收强度;k为常数;n取0.5,对于直接带隙半导体n=2,对于间接带隙半导体n=0.5,TiO2为间接带隙半导体;hν为吸收光子能量;Eg为带隙宽度[40]。由图13(c)、13(d)可知,纯TiO2带隙宽度为2.90 eV,Mo2C负载后TiO2带隙宽度减小至2.80 eV,进一步引入Cu后TiO2带隙宽度减小至2.78 eV。说明Mo2C和Cu的负载可能在TiO2禁带中引入杂质能级,从而导致其带隙变窄。

图13 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的紫外可见光吸收光谱及其带隙能
Fig.13 UV-Vis absorption spectra and band gap energy of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
半导体的荧光发射现象与光生载流子的复合率有关。光致发光光谱(PL)可反映光生电子与空穴对的分离效率,一般来说光催化剂的荧光强度越低[41]表示其电荷分离能力越强、光生载流子越不易发生复合。所有样品光致发光光谱非常相似,说明Mo2C和Cu的负载不会导致新光致发光现象的产生。TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的催化剂的光致发光光谱如图14所示,纯TiO2在400和470 nm附近[41-42]表现出2个很强的荧光发射峰,这说明大部分光生载流子发生复合。由图14(a)可知,负载Mo2C后,TiO2的荧光信号强度随Mo2C负载量的增加先降低后增加,Mo2C负载量为3%时PL信号强度最低,而Mo2C负载量为5%时PL信号强度升高。这可能是由于适量Mo2C可有效捕获光生电子,而过量Mo2C反而会成为光生电子与空穴的复合中心。

图14 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的催化剂的光致发光光谱
Fig.14 Photoluminescence spectra of catalysts of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
由图14(b)可知,Mo2C和Cu共负载时,随催化剂中Cu含量增加,TiO2的荧光信号强度先降低后增加。其中,3% 3Mo2C-0.60Cu/TiO2催化剂PL信号强度最低。说明Cu的引入可抑制光生载流子复合,而过量Cu反而会成为光生电子与空穴的复合中心。
为进一步说明3% 3Mo2C-0.60Cu/TiO2具有优异光催化活性的原因,使用电化学工作站(上海辰华760e)对催化剂进行光电化学性质表征。利用瞬态光电流响应谱、电化学阻抗谱表征了催化剂在反应过程中电荷的分离与转移效率。一般认为,光电流密度越高,高频区电化学阻抗越小,则光驱动电荷分离和转移的效率越高[43]。TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的瞬态光电流响应谱及电化学阻抗谱如图15所示,受到光照时,3% 3Mo2C-0.60Cu/TiO2光电流密度最大,说明其光生载流子分离效率最高(图15(a))。同时,3% 3Mo2C-0.60Cu/TiO2在高频区域具有比TiO2和3% Mo2C/TiO2更小的电化学阻抗,说明其电荷转移阻抗最小,有利于电荷转移(图15(b))。

图15 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的瞬态光电流响应谱及电化学阻抗谱
Fig.15 Transient photocurrent response spectra and electrochemical impedance spectra of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
2.4 光催化剂的能带结构与光催化反应机理
TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2在不同频率下的莫特-肖特基曲线如图16所示(C为界面电容)。3个样品的莫特-肖特基曲线均为正斜率,说明其均为n型半导体。将1.0、1.5 kHz下的莫特-肖特基曲线做切线并外推到X轴即可得到半导体材料的平带电位。TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2的平带电位分别为-0.39、-0.51及-0.44 V(vs.Ag/AgCl,pH=7)。根据式(2)[44],将其转化为相对于标准氢电极的电势ENHE(Potential of Normal Hydrogen Electrode,NHE,pH=7):
ENHE=EAg/AgCl 0.197 6。
(2)
其中,EAg/AgCl为半导体相对于Ag/AgCl电极的电势。计算出TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2费米能级的位置Ef分别为-0.19、-0.31及-0.24 V(vs.NHE,pH=7)。

图16 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的莫特-肖特基曲线及XPS价带谱
Fig.16 Mott-Schottky curves and XPS valence band spectra of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
由图16(d)可知,通过XPS价带谱测定了半导体材料的价带顶部位置,TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2价带位置分别为2.84、2.62及2.36 eV(半导体价带最大值(Valance Band Maximu)Evb*,相对于真空能级)。利用式(3)转换成相对于标准氢电极(NHE,pH=7)的电势[45-46]:
ENHE=Φ Evb*-4.44。
(3)
其中,Φ为XPS仪器的功函数,取4.2 eV。得到TiO2、3% Mo2C/TiO2及3% 3Mo2C-0.60Cu/TiO2价带位置分别为2.60、2.38及2.12 V(vs.NHE,pH=7)。再根据带隙宽度推算出导带位置,分别为-0.30、-0.42及-0.66 V。结果表明,这3种材料的费米能级与导带位置较接近,均为n型半导体。TiO2中引入Mo2C和Cu后,导致TiO2导带位置升高从而使光生电子还原性更强。

图17 TiO2、Mo2C/TiO2及Mo2C-Cu/TiO2催化剂的能带结构
Fig.17 Band structure of TiO2,Mo2C/TiO2 and Mo2C-Cu/TiO2 catalysts
基于以上分析,推测了催化剂的能带结构和可能的光催化反应机理,如图17所示。首先,在紫外光照射下,TiO2被激发产生光生电子和空穴对。光生电子跃迁至半导体导带,同时在价带留下空穴。光生空穴可被牺牲剂甲醇迅速消耗,而光生电子可被助催化剂Mo2C和Cu捕获并将电子转移给CO2,生成CH4和CO。Mo2C和Cu的负载在TiO2价带顶部引入了新能级,测得带隙能反推出其导带位置升高,光生电子具有更强的还原性。
3 结 论
1)Mo2C的负载可显著促进CH4和H2的产生,光照4 h后其累计产量分别为60.5和165.1 μmol/g,为纯TiO2的4.4倍和2.4倍。引入Cu后,可抑制H2生成提高了对产物CH4的选择性,其CH4累计产量为76.1 μmol/g,为纯TiO2的5.6倍。
2)Mo2C 和Cu的引入在TiO2价带顶部掺入了杂质能级,减小了纯TiO2带隙宽度,并提高了半导体导带位置从而使光生电子具有更高的反应活性。
3) Mo2C和Cu的负载可有效捕获光生电子,促进电荷分离与转移并抑制光生载流子的复合,从而提高了光催化反应的活性。
[1] BP.The statistical review of world energy analyses data on world energy markets from the prior year[EB/OL].(2022-06-30)[2022-09-20].https://www.bp.com/content/dam/bp/business-sites/en/global/corporate/pdfs/energy-economics/statistical-review/bp-stats-review-2022-full-report.pdf?_ga=2.107068864.397128412.1668155129-259396334.1668155129.
[2] 赵江婷,熊卓,赵永椿,等.热助光催化CO2还原研究进展与展望[J].洁净煤技术,2021,27(2):132-138.
ZHAO Jiangting,XIONG Zhuo,ZHAO Yongchun,et al.Progress and prospect of thermal assisted photocatalytic CO2 reduction[J].Clean Coal Technology,2021,27(2):132-138.
[3] XIONG Z,XU Z,LI Y,et al.Incorporating highly dispersed and stable Cu into TiO2 lattice for enhanced photocatalytic CO2 reduction with water[J].Applied Surface Science,2020,507:145095.
[4] XIONG Z,LEI Z,KUANG C,et al.Selective photocatalytic reduction of CO2 into CH4 over Pt-Cu2O TiO2 nanocrystals:The interaction between Pt and Cu2O cocatalysts[J].Applied Catalysis B:Environmental,2017,202:695-703.
[5] WANG J,LI Y,ZHAO J,et al.Reversed selectivity of photocataly-
tic CO2 reduction over metallic Pt and Pt(ii) oxide cocatalysts[J].Physical Chemistry Chemical Physics:PCCP,2021,23(15):9407-9417.
[6] SU K,CHEN C,WU R.Preparation of Pd/TiO2 nanowires for the photoreduction of CO2 into renewable hydrocarbon fuels[J].Journal of the Taiwan Institute of Chemical Engineers,2019,96:409-418.
[7] LONG L,MATTHEW S,SYLVIE C,et al.Immobilization of Mn(i) and Ru(ii) polypyridyl complexes on TiO2 nanoparticles for selective photoreduction of CO2 to formic acid[J].Chemical Communications,2019,55(90):13598-13601.
[8] WANG A,WU S,DONG J,et al.Interfacial facet engineering on the Schottky barrier between plasmonic Au and TiO2 in boosting the photocatalytic CO2 reduction under ultraviolet and visible light irradiation[J].Chemical Engineering Journal,2021,404:127145.
[9] TAHIR M,TAHIR B,AMIN N A S.Gold-nanoparticle-modified TiO2 nanowires for plasmon-enhanced photocatalytic CO2 reduction with H2 under visible light irradiation[J].Applied Surface Science,2015,356:1289-1299.
[10] 高艳,吴先应,熊卓,等.Ag负载g-C3N4及其光催化还原CO2研究[J].工程热物理学报,2017,38(2):411-415.
GAO Yan,WU Xianying,XIONG Zhuo,et al.Efficient photocatalytic reduction of CO2 over Ag-modified g-C3N4 catalyst[J].Journal of Engineering Thermophysics,2017,38(2):411-415.
[11] ALABA P A,ABBAS A,HUANG J,et al.Molybdenum carbide nanoparticle:Understanding the surface properties and reaction mechanism for energy production towards a sustainable future[J].Renewable &Sustainable Energy Reviews,2018,91:287-300.
[12] WAN C,REGMI Y N R,LEONARD B M L.Multiple phases of molybdenum carbide as electrocatalysts for the hydrogen evolution reaction[J].Angewandte Chemie International Edition,2014,53(25):6407-6410.
[13] WAN W,TACKETT B M,CHEN J G,et al.Reactions of water and C1 molecules on carbide and metal-modified carbide surfaces[J].Chemical Society Reviews,2017,46(7):1807-1823.
[14] YUE X,YI S,WANG R,et al.A novel architecture of dandelion-like Mo2C/TiO2 heterojunction photocatalysts towards high-performance photocatalytic hydrogen production from water splitting[J].Journal of Materials Chemistry A,2017,5(21):10591-10598.
[15] LIU J,WANG P,GAO L,et al.Insitu sulfuration synthesis of heterostructure MoS2-Mo2C@C for boosting the photocatalytic H2 production activity of TiO2[J].Journal of Materials Chemistry C,2022,10(8):3121-3128.
[16] LI H,HONG W,CUI Y,et al.Effect of Mo2C content on the structure and photocatalytic property of Mo2C/TiO2 catalysts[J].Journal of Alloys and Compounds,2013,569:45-51.
[17] LIU Y,WAN L,WANG J,et al.Binary electrocatalyst composed of Mo2C nanocrystals with ultra-low Pt loadings anchored in TiO2 nanotube arrays for hydrogen evolution reaction[J].Applied Surface Science,2019,509:144679.
[18] GAO L,LIU J,LONG H,et al.One-step calcination synthesis of WC-Mo2C heterojunction nanoparticles as novel H2 production cocatalysts for enhanced photocatalytic activity of TiO2[J].Catalysis Science &Technology,2021,11(22):7307-7315.
[19] MARQUART W,RASEALE S,PRIETO G,et al.CO2 reduction over Mo2C-based catalysts[J].ACS Catalysis,2021,11(3):1624-1639.
[20] LIU J,WANG P,FAN J,et al.Carbon-coated cubic-phase molybdenum carbide nanoparticle for enhanced photocatalytic H2-evolution performance of TiO2[J].Journal of Energy Chemistry,2020,51:253-261.
[21] LIU J,HODES G,YAN J,et al.Metal-doped Mo2C (metal = Fe,Co,Ni,Cu) as catalysts on TiO2 for photocatalytic hydrogen evolution in neutral solution[J].Chinese Journal of Catalysis,2021,42(1):205-216.
[22] DIAO Y,ZHANG X,LIU Y,et al.Plasma-assisted dry reforming of methane over Mo2C-Ni/Al2O3 catalysts:Effects of β-Mo2C promoter[J].Applied Catalysis B:Environmental,2022,301:120779.
[23] BRUNGS A J,YORK A P,CLARIDGE J B,et al.Dry reforming of methane to synthesis gas over supported molybdenum carbide catalysts[J].Catalysis Letters,2000,70(3/4):117-122.
[24] WANG J,LI Y,ZHAO J,et al.PtCu alloy cocatalysts for efficient photocatalytic CO2 reduction into CH4 with 100% selectivity[J].Catalysis Science &Technology,2022,12(11):3454-3463.
[25] JUNG K T,KIM W B,RHEE C H,et al.Effects of transition met-
al addition on the solid-state transformation of molybdenum trioxide to molybdenum carbides[J].Chemistry of Materials,2015,16(2):307-314.
[26] GIORDANO C,ANTONIETTI M.Synthesis of crystalline metal nitride and metal carbide nanostructures by sol-gel chemistry[J].Nano Today,2011,6(4):366-380.
[27] THEERTHAGIRI J,SENTHIL R A,BURAIDAH M H,et al.Synthesis of α-Mo2C by carburization of α-MoO3 nanowires and its electrocatalytic activity towards Triiodide reduction for dye-sensitized solar cells[J].Journal of Materials Science &Technology,2016,32(12):1339-1344.
[28] YU J,WANG G,CHENG B,et al.Effects of hydrothermal temperature and time on the photocatalytic activity and microstructures of bimodal mesoporous TiO2 powders[J].Applied Catalysis B:Environmental,2007,69(3-4):171-180.
[29] FANG B,CHAUDHARI N K,KIM M,et al.Homogeneous deposition of platinum nanoparticles on carbon black for proton exchange membrane fuel cell[J].Journal of the American Chemical Society,2009,131(42):15330-15338.
[30] ZHANG L H,KOKA R V.A study on the oxidation and carbon diffusion of TiC in alumina titanium carbide ceramics using XPS and Raman spectroscopy[J].Materials Chemistry and Physics,1998,57(1):23-32.
[31] LIN H,LIU N,SHI Z,et al.Cobalt-doping in molybdenum-carbide nanowires toward efficient electrocatalytic hydrogen evolution[J].Advanced Functional Materials,2016,26(31):5590-5598.
[32] ANG H,TAN H T,LUO Z M,et al.Hydrophilic nitrogen and sulfur Co-doped molybdenum carbide nanosheets for electrochemical hydrogen evolution[J].Small,2015,11(47):6278-6284.
[33] ZHENG X,CHEN Y,ZHENG X,et al.Electronic structure engineering of LiCoO2 toward enhanced oxygen electrocatalysis[J].Advanced Energy Materials,2019,9(16):1803481-1803482.
[34] ZHAI Q,XIE S,FAN W,et al.Photocatalytic conversion of carb-
on dioxide with water into methane:Platinum and copper(I) oxide Co-catalysts with a core-shell structure[J].Angewandte Chemie International Edition,2013,52(22):5776-5779.
[35] CHEN B R,NGUYEN V H,WU J C S,et al.Production of renewable fuels by the photohydrogenation of CO2:Effect of the Cu species loaded onto TiO2 photocatalysts[J].Physical Chemistry Chemical Physics,2016,18(6):4942-4951.
[36] TAN J Z Y,FERNANDEZ Y,LIU D,et al.Photoreduction of CO2 using copper-decorated TiO2 nanorod films with localized surface plasmon behavior[J].Chemical Physics Letters,2012,531:149-154.
[37] HUA Y N,SHEN Y,LI K,et al.Studies on XPS valence state analysis of copper materials[C]//2016 IEEE 37th International Electronics Manufacturing Technology (IEMT) &18th Electronics Materials and Packaging (EMAP) Conference.Georgetown Malaysia:IEEE,2016.
[38] WANG W,AN W,RAMALINGAM B,et al.Size and structure ma-tter:Enhanced CO2 photoreduction efficiency by size-resolved ultrafine Pt nanoparticles on TiO2 single crystals[J].Journal of the American Chemical Society,2012,134(27):11276-11281.
[39] WANG W,PARK J,BISWAS P.Rapid synthesis of nanostructur-
ed Cu-TiO2-SiO2 composites for CO2 photoreduction by evaporation driven self-assembly[J].Catalysis Science &Technology,2011,1(4):593-600.
[40] YOON M,SEO M,JEONG C,et al.Synthesis of liposome-templated titania nanodisks:Optical properties and photocatalytic activities[J].Chemistry of Materials,2005,17(24):6069-6079.
[41] WU J,LIU Q,GAO P,et al.Influence of praseodymium and nitrogen co-doping on the photocatalytic activity of TiO2[J].Materials Research Bulletin,2011,46(11):1997-2003.
[42] WANG C,SHI H,LI Y.Synthesis and characterization of natural zeolite supported Cr-doped TiO2 photocatalysts[J].Applied Surface Science,2012,258(10):4328-4333.
[43] ZHAO S,LI K,DU J,et al.Facile construction of a hollow In2S3/polymeric carbon nitride heterojunction for efficient visible-light-driven CO2 reduction[J].ACS Sustainable Chemistry &Engineering,2021,9(17):5942-5951.
[44] TANG J,KONG X Y,NG B,et al.Midgap-state-mediated two-step photoexcitation in nitrogen defect-modified g-C3N4 atomic layers for superior photocatalytic CO2 reduction[J].Catalysis Science &Technology,2019,9(9):2335-2343.
[45] SHI H,LONG S,HOU J,et al.Defects promote ultrafast charge separation in graphitic carbon nitride for enhanced visible-light-driven CO2 reduction activity[J].Chemistry:A European Journal,2019,25(19):5028-5035.
[46] YU H,SHI R,ZHAO Y,et al.Alkali-assisted synthesis of nitrogen deficient graphitic carbon nitride with tunable band structures for efficient visible-light-driven hydrogen evolution[J].Advanced Materials,2017,29(16):1605148.
Performance of Mo2C/Cu co-loaded TiO2 photocatalytic CO2 reduction

移动阅读
LI Yang,YU Huijian,JIN Lijun,et al.Performance of Mo2C/Cu co-loaded TiO2 photocatalytic CO2 reduction[J].Clean Coal Technology,2023,29(5):56-67.