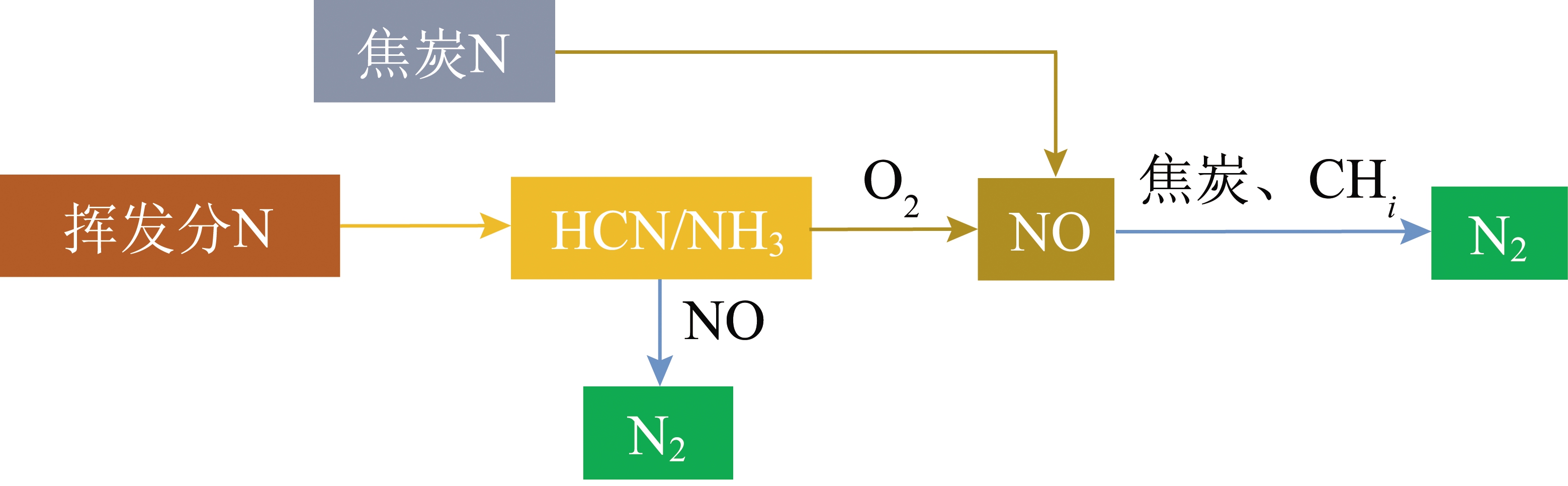
Na-K协同作用对湿法脱硝NOx演化过程的影响机制
0 引 言
空气污染对人类健康和环境造成严重危害,国家对燃烧污染物排放的要求日趋严格,其中钢铁(球团、烧结)、冶金、焦化、化工等行业排放的NOx和SO2更是环保治理的重点[1-3]。为应对空气污染,中国制定了严格的NOx和SO2排放标准,其中,控制NOx排放的方法主要是选择性非催化还原(SNCR)、选择性催化还原(SCR)和溶液吸收。目前NH3选择性催化还原NOx(NH3-SCR)是脱硝领域应用最广泛、最有效的技术[4-5],而控制SO2排放主要通过石灰石-石膏湿法脱硫(WFGD)实现[6- 7]。值得注意的是,一方面,使用石灰石/石灰-石膏法去除SO2将产生大量石膏,大部分脱硫石膏未得到有效利用,被丢弃或填埋,造成资源浪费和环境污染[8];另一方面,联合脱硫脱硝系统在WFGD基础上加装SCR使系统复杂化,导致设备投资和运行成本增大,同时存在氨易泄漏和催化剂易中毒等问题[9-10]。20世纪80年代后,分离式脱硫脱硝技术存在设备复杂、占地面积大、投资和运行成本高等问题。而同时进行脱硫脱硝系统时,结构紧凑,投资和运行成本低,但采用固相脱除SO2与NOx过程中存在竞争,SO2与NH3结合能力远强于NOx,极易造成硫酸铵盐沉积,进而引起催化剂不可逆失活[11]。因此,开发一种能够实现同时脱硫脱硝,具有高效率、低成本的新工艺具有重要意义。各国对联合脱硫脱硝进行了大量研究,开发了70多种同时脱硫脱硝工艺,包括过渡金属离子催化法、络合吸附法、氧化法、杂多酸法、尿素法、电子束辐照法、脉冲电晕等离子体法、固相吸附再生法、光催化法和吸附剂喷洒方法等[12-14],由于设备复杂,试验条件苛刻,多数不具备商业运用价值。
通过总结已有技术,湿法吸收虽能够高效脱除烟气中二氧化硫,但对氮氧化物的脱除效率不高[15-16],由于烟气中90%以上的氮氧化物由于难溶于水的NO,因此,采用高效NO预氧化技术将其氧化为溶解度较强的NO2是实现湿法脱硫脱硝技术的关键。先前研究中,液相氧化吸收主要应用KMnO4溶液[6,17-18]、NaClO溶液[19]以及NaClO2溶液[20]等氧化性物质对烟气进行预氧化,使NO转化为易溶水的 其中SO2转化为
其中SO2转化为 最后通过碱液吸收生成硝酸盐和硫酸盐,实现氮氧化物及SO2脱除。
最后通过碱液吸收生成硝酸盐和硫酸盐,实现氮氧化物及SO2脱除。
基于高锰酸钾(KMnO4)强氧化性、易获得等特性,采用0.1 mol/L高锰酸钾(KMnO4)溶液进行预氧化,NO预氧化后通入SO2,利用一定比例的NaOH/KOH作为吸收剂对混合SO2/NO去除系统进行测试。评估不同操作参数对鼓泡塔反应器NO去除效率的影响,确定了最佳试验条件,验证了二氧化硫和氮氧化物在液体中的协同作用,并对相关反应机理进行了假设。
1 材料和方法
1.1 试验装置和材料
主要化学试剂由麦克林集团化学有限公司提供。化学试剂有NaOH(≥96.0%,分析级)、KOH(≥96.0%,分析级)、KMnO4(≥96.0%,分析级)、Na2SO3(≥96.0%,分析级)。试验由4部分组成,分别为:烟气模拟系统、预氧化系统、吸收系统和气体取样分析系统,如图1所示。

图1 试验系统示意
Fig.1 Diagram of experimental system
模拟烟气系统中使用的标准气体为N2(>99.99%)、O2(21%)、SO2 /N2(体积分数2%的SO2)和NO/N2(体积分数2%的NO),所有气体均由鸿运达特种气体有限公司(中国济南)提供。模拟烟气中的SO2、NO和O2由质量流量计控制,分别为2.5、12.5和238.0 mL/min。
对于预氧化系统,考虑到气体停留时间及分散度对预氧化的直观作用,主要使用100 mL带石英砂芯的鼓泡反应器作为预氧化反应器,其中KMnO4添加量为50 mL,使反应器床层充分浸没,增加气相物种预氧化时间,增强氧化效果。
气体吸收系统与预氧化系统类似,需增加液相的湍流阻力,增加吸收的驱动力,降低传质阻力,提高湿法脱氮效率。因此,使用100 mL气体吸收瓶作为吸收反应器,使用碱液同时进行湿法脱硫脱硝。需要注意的是,为使反应温度保持恒温,使用水浴锅将反应器及预氧化器充分浸没,通过热电偶记录并控制水温。
气体取样分析系统中,反应物经预氧化、吸收后,通过Gasmat-4000测试尾气中气体成分,该分析仪包含红外传感器、预热器和过滤转装置,提供稳定信号、良好精度和良好重复性,测定空气中的NOx、SO2、N2O浓度。其转化率见式(1)、式(2):

(1)

(2)
式中,η(NOx)、η(SO2)分别为NOx、SO2的转化率,%;φ(NOx)in和φ(SO2)in分别为模拟烟气进口处NOx和SO2体积分数,10-6;φ(NOx)out和φ(SO2)out分别为处理后烟气中NOx和SO2体积分数,10-6。
反应完成后,根据测试结果,选择较优碱液比,取样器取适量吸收液,通过IC-8618型离子色谱测量吸收液中 等离子浓度,试验过程中,所有试剂和吸收剂均用去离子水制备。
等离子浓度,试验过程中,所有试剂和吸收剂均用去离子水制备。
1.2 色谱条件的确定
测试在IC-8618离子色谱仪上进行,该仪器配备全自动进样器以及淋洗液装置,LH-YA抑制型电导检测器,选用阴离子交换色谱柱。首先打开仪器主机以及工作站软件,预热5~10 min,并将流量设定为0.3 mL/min,开启色谱泵并将色谱柱接入流路。当压力稳定时,调节流量至0.6 mL/min,电导值稳定后进行采样。其中,淋洗液为1.7 mmol/L NaHCO3 1.8 mmol/L Na2CO3;流速1.0 mL/min;柱温30 ℃;抑制电流50 mA。
1.3 试验条件
1)预氧化剂的选择。分别采用高锰酸钾、亚氯酸钠、过氧化氢测定NO预氧化效果。
2)碱液吸收剂。研究不同吸收剂对同时脱除效率的影响,并与单纯去离子水吸收时的结果进行比较。
3)吸收剂浓度。测定了吸收剂浓度为0.010 0、0.002 0、0.003 0、和0.000 5 mol/L时脱硫脱硝效率,吸收液体积为80 mL。
4)气体组分。测定添加SO2以及Na2SO3对脱硝效率的影响。通过向气体组分中添加SO2以及向吸收剂中添加Na2SO3实现。
5)反应时间。测定反应时间为1、2、5、10、20、30 min的脱硫脱硝效率,并记录吸收液中 等离子峰强度和位置变化。
等离子峰强度和位置变化。
2 结果和讨论
2.1 去离子水、NaOH和KOH吸收剂对未预氧化NOx的吸收性能
NaOH、KOH对NOx吸收性能优异,是湿法烟气脱硫最常用的吸收剂,为比较去离子水、NaOH和KOH对未经预氧化NOx吸收性能,分别采用去离子水,0.01 mol/L NaOH,0.01 mol/L KOH及0.01 mol/L NaOH、KOH混合液(n(NaOH)∶n(KOH)=1∶2),0.01 mol/L NaOH、KOH混合液(n(NaOH)∶n(KOH)=2∶1)作为吸收剂在反应温度50 ℃下进行NO吸附性能测试(湿法脱硝工业应用温度为40~60 ℃,因此选择50 ℃为反应温度)。结果如图2所示,可知所有组分在初始时间内即出现断崖式下降,在10 min内转化率均降至0,这主要是由于NO难溶于水,吸收驱动力较差。其中,去离子水的吸收效果最差,基本不存在吸收效果[21],与之相比,在吸收液中添加NaOH、KOH后,NOx吸收效率略有改善,在5 min时吸收率可维持在10%左右,可以看出Na、K离子浓度不同所造成的微弱差异,即K离子浓度高的吸收剂吸收时间略长,而NO难溶于水,几乎不与碱液反应[12]。考虑到试验结果的差异性,这可能是由于Na、K离子的存在促进了NO氧化,或增加了NO溶解度,且K离子的促进作用强于Na离子。

图2 去离子水、NaOH和KOH直接吸收法的脱硝效率
Fig.2 Denitrification efficiency of direct absorption method using deionized water, NaOH and KOH
2.2 预氧化剂的选择
由第2.1节可知,在未经氧化的条件下,无论何种吸收剂对NO几乎没有吸收作用。因此,分别用浓度为0.1 mol/L的KMnO4、NaClO2以及H2O2进行对比试验,为排除其他离子影响,采用0.01 mol/L的NaOH作为吸收剂并在50 ℃进行测试。KMnO4、NaClO2、H2O2预氧化对NO转化率的影响如图3所示,显示了3种氧化剂预氧化对NO转化率随时间的变化关系。结果表明,经3种氧化剂处理后都能有效提高NO去除效率,并能长时间使脱除率保持在60%以上。通过图3对3种氧化剂综合评定,其去除能力KMnO4>H2O2≥NaClO2,30 min平均去除率分别为85.7%、82.3%、80.7%,以KMnO4为氧化剂的优势较明显,且图3表明,由于KMnO4存在持久氧化性,以KMnO4为预氧化剂的NO吸收效率曲线与其他2种相比较为稳定,随时间不断延长转化率存在缓慢下降趋势。总体来说,强氧化剂对NO去除效率的提高幅度大于弱氧化剂,因此,在后续试验中,优选0.1 mol/L的KMnO4作为预氧化氧化剂。然而,强氧化剂比弱氧化剂需要更高的成本[22-24],因此,在实际应用中,添加剂的种类和用量根据成本效益确定,需考虑污染物排放标准、附加成本以及安全和设备。

图3 KMnO4、NaClO2、H2O2预氧化对NO转化率的影响
Fig.3 Effects of pre-oxidation with KMnO4, NaClO2 and H2O2 on the conversion rate of NO
2.3 不同种类吸收液对NOx吸收性能的影响
第2.1节表明Na、K离子对NO的吸附存在某种促进作用,为更直观探究其影响,在预氧化条件下通过0.01 mol/L吸收液分别探究了不同成分、比例对NO脱除的影响,结果如图4所示。相比图3,所有吸收液的吸附效率均有明显改善,试验30 min转化率仍保持在60%以上,并能保持稳定的吸收性能。与NaOH相比,KOH具有优异的NOx吸收性能,且吸收液中K离子含量越高,其吸收性能越优越,这表明吸收效率与K离子存在正相关性,单纯的KOH吸收液30 min平均吸收率高达99.4%,而单纯的NaOH平均吸收率仅有86.9%,需要特别指出的是,K离子含量高的样品转化率更加稳定,以n(NaOH)∶n(KOH)=1∶2为例,测试初期转化率由94.3%降至88.6%,延长至30 min转化率仍保持在86%以上,说明K离子的存在,可能更有利于促进NOx等物质的扩散作用,使液膜阻力减少,增加了气膜向液膜扩散的速度,从而促进其吸收效果,同时,吸收液扩散阻力减少,可使碱液充分发挥作用,从而保证了其稳定的转化率[25]。

图4 0.01 mol/L NaOH、KOH、n(NaOH)∶n(KOH)=1∶2、n(NaOH)∶n(KOH)=2∶1吸收液对NO转化率的影响
Fig.4 Effects of absorption solutions of 0.01 mol/L NaOH, KOH,n(NaOH)∶n(KOH)=1∶2,n(NaOH)∶n(KOH)=2∶1 on the conversion rate of NO
2.4 吸收液浓度对NOx吸收性能的影响
分别以浓度为0.010、0.020、0.030、0.005 mol/L的NaOH、KOH、n(NaOH)∶n(KOH)=1∶2、n(NaOH)∶n(KOH)=2∶1吸收液,测试不同浓度吸收液对吸收效率的影响,测试结果如图5所示。对比不同浓度的影响发现,吸收剂浓度较低时,其随时间变化不稳定。以NaOH为例,浓度为0.005 mol/L时,其初始效率为91.3%,随反应时间延长逐渐下降,测试30 min时,转化率仅为80%,其他成分吸收液与之类似。在所有浓度中,0.020 mol/L效果最佳,其中以KOH为吸收剂的样品30 min吸收率高达100%,随碱液浓度增加,吸收率未明显上升,部分样品略下降,说明OH-浓度达到一定值后,对NOx的吸收效果影响不大。这由于反应过程属于气液接触反应,继续增加浓度反而会降低气体的扩散系数和溶解度,直接影响NOx的溶解度[26-27]。由图5(b)可知,以KOH为吸收剂的样品受浓度影响小,高于0.010 mol/L后,均能表现出优异的吸收度,仅在低浓度下随测试时间下降。通过对比不同溶液中K离子浓度发现,图5(c)中n(NaOH)∶n(KOH)=1∶2比(NaOH)∶n(KOH)=2∶1中的K离子浓度高,NOx转化率更加稳定,图5(b)中KOH仍表现出最佳吸收活性,并随K离子比例下降而减弱,但仍保持高于60%的转化率。

图5 吸收液浓度对NOx的吸附效率的影响
Fig.5 Influence of absorbent concentration on the NOx adsorption efficiency
2.5 添加SO2对脱硝效率的影响
为探讨SO2对脱硝效率的影响,并实现同步脱硫脱硝,进行了SO2添加试验。根据前期分析,利用KMnO4预氧化并加以0.020 mol/L不同种类吸收液,研究向吸收液添加2.5 mL/min SO2对脱硝效率影响,并且检测尾气中SO2含量,转化率如图6所示。可知所有样品均能保持30 min稳定的吸收率,脱硝效率均保持在75%以上。据文献[19]报道,由于NO从气相中的大部分转移到液相中,并与![]() 发生氧化还原反应,并在液相中氧化为NO2。由于吸收部分前存在预氧化系统,预氧化后NO含量较低,因此,可被认为NO发生了多次氧化过程。首先被KMnO4氧化为NO2,由于存在扩散阻力和气膜效应,部分逃逸的NO在吸收系统中继续与
发生氧化还原反应,并在液相中氧化为NO2。由于吸收部分前存在预氧化系统,预氧化后NO含量较低,因此,可被认为NO发生了多次氧化过程。首先被KMnO4氧化为NO2,由于存在扩散阻力和气膜效应,部分逃逸的NO在吸收系统中继续与![]() 反应进而被吸收液溶解吸收,而在初期效率下降后保持稳定,可能与NO扩散速率及气体流量有关,流量过大时,NO液相扩散受限,影响NO的氧化吸收[28-29]。与前期测试明显不同的是在添加SO2后,单一成分的吸收剂NO转化率明显低于混合样品,其中NaOH、KOH吸收液30 min平均转化率为80.1%和81.6%,而同一条件下测试Na、K离子协同吸收液30 min转化率为83.8%和85.9%。可见,气体组分中存在SO2时,Na、K离子发生了协同作用,这种协同作用促进了NO吸收及转化。同时SO2去除效率几乎为100%,这与吸收液组分无关,是由于SO2易溶于碱性液体,迅速与碱液发生反应[17]。
反应进而被吸收液溶解吸收,而在初期效率下降后保持稳定,可能与NO扩散速率及气体流量有关,流量过大时,NO液相扩散受限,影响NO的氧化吸收[28-29]。与前期测试明显不同的是在添加SO2后,单一成分的吸收剂NO转化率明显低于混合样品,其中NaOH、KOH吸收液30 min平均转化率为80.1%和81.6%,而同一条件下测试Na、K离子协同吸收液30 min转化率为83.8%和85.9%。可见,气体组分中存在SO2时,Na、K离子发生了协同作用,这种协同作用促进了NO吸收及转化。同时SO2去除效率几乎为100%,这与吸收液组分无关,是由于SO2易溶于碱性液体,迅速与碱液发生反应[17]。

图6 添加SO2对脱硝效率对脱硝效率的影响
Fig.6 Influence of SO2 addition on the denitrification efficiency
2.6 添加Na2SO3对脱硝效率的影响
Na2SO3对SO2的吸收性能优异,是湿法烟气脱硫最常用的吸收剂。在传统的W-L工艺中,采用Na2SO3作为吸收剂,其优点是富集的SO2可通过吸收后的热气汽提或蒸发进行再生、分离、回收和再利用[30-31],主要发生以下反应:

(3)

(4)
在第2.5节中,考虑到SO2存在与前期测试的差异性,而SO2溶于碱液主要转化为![]() 因此,进一步向吸收液中添加微量Na2SO3(0.001 mol/L),以此探究
因此,进一步向吸收液中添加微量Na2SO3(0.001 mol/L),以此探究![]() 对NO转化率的影响,结果如图7所示。相比图6,各成分吸收剂之间差异更微弱,仅n(KOH):n(NaOH)=2∶1样品在10 min后吸收转化率更优异,然而这种优势微弱,仅比其他样品提高了2%的转化率。在吸收剂中主要存在以下反应:
对NO转化率的影响,结果如图7所示。相比图6,各成分吸收剂之间差异更微弱,仅n(KOH):n(NaOH)=2∶1样品在10 min后吸收转化率更优异,然而这种优势微弱,仅比其他样品提高了2%的转化率。在吸收剂中主要存在以下反应:

图7 添加Na2SO3对脱硝效率的影响
Fig.7 Influence of Na2SO3 addition on the denitrification efficiency

(5)

(6)

(7)

(8)

(9)

(10)
H OH-![]() H2O。
H2O。
(11)
根据试验结果推测,当吸收液中仅为碱性吸收液时,K离子的存在促进了反应(5)的正向进行,而在液体中存在NO进一步优化了反应(7)的正向进行,从而表现出较优的转化率;而吸收液中存在![]() 反应(9)(10)被激活,使NO2与
反应(9)(10)被激活,使NO2与![]() 反应被消耗,而反应(5)产生NO是由于NO2的消耗被扩散,从而添加SO2以及
反应被消耗,而反应(5)产生NO是由于NO2的消耗被扩散,从而添加SO2以及![]() 表现出相较KOH更差的转化率。对于图6、7,推测在Na、K离子协同作用下,通过
表现出相较KOH更差的转化率。对于图6、7,推测在Na、K离子协同作用下,通过![]() 的驱动,促进了反应(6)、(10)等正向进行,使NO2被大量吸收。
的驱动,促进了反应(6)、(10)等正向进行,使NO2被大量吸收。
3 离子色谱测定吸收液中阴离子浓度
根据前期结果分析,优选0.02 mol/L吸收液进行离子色谱测定。
3.1 碱液中离子性质的变化
测定未添加S元素的碱液吸收NO离子浓度的变化如图8所示,柱温箱温度为50 ℃时,峰分离度较好,各解析峰间边界明显,根据对比标准物质的峰谱解离时间,其中在2.638、5.320、5.740、7.047、13.023 min处的峰值分别归属于 以及硝酸根衍生物,由于试验误差,仍能检测到微弱的S存在。由图8可知,通过与未参与反应的吸收液对比,所有峰的位置和强度基本无明显差别,趋于一致,仅在5.740 min处的峰值随取样时间延长呈明显增强趋势,这主要归因于预氧化后的NO在碱液中的吸收转化导致
以及硝酸根衍生物,由于试验误差,仍能检测到微弱的S存在。由图8可知,通过与未参与反应的吸收液对比,所有峰的位置和强度基本无明显差别,趋于一致,仅在5.740 min处的峰值随取样时间延长呈明显增强趋势,这主要归因于预氧化后的NO在碱液中的吸收转化导致![]() 离子累积。通过对比图8(a)、8(b)可知,KOH吸收液中
离子累积。通过对比图8(a)、8(b)可知,KOH吸收液中![]() 离子强度明显高于NaOH吸收液,这与第2.2节中测试相吻合,即吸收液中含K更有利于NO2的溶解与转化。据报道,NO2溶于碱液发生歧化反应[32],即
离子强度明显高于NaOH吸收液,这与第2.2节中测试相吻合,即吸收液中含K更有利于NO2的溶解与转化。据报道,NO2溶于碱液发生歧化反应[32],即

图8 单纯碱液吸收NO中不同组分阴离子随测试时间的变化
Fig.8 Evolution of different component anions in the absorption of NO by pure alkaline solutions over time

(12)
但考虑到在色谱中未明显看出
强度的变化,推测在碱液中同时存在反应(6)~(8),使生成的 被进一步消耗,转化为稳定的
被进一步消耗,转化为稳定的![]()
3.2 添加SO2碱液中离子性质的变化
进一步测试了预氧化后吸收碱液中添加2.5 mL/min SO2气体中离子的变化,结果如图9所示。如前所述,在5.74 min处解离峰归属于![]() 对比图8可以明显看出,添加SO2后,其峰值随测试时间出现累加效应,并在测试30 min后达到最高,图9(c)、9(d)尤为明显;在17.3 min处保留时间较长的峰值归属于
对比图8可以明显看出,添加SO2后,其峰值随测试时间出现累加效应,并在测试30 min后达到最高,图9(c)、9(d)尤为明显;在17.3 min处保留时间较长的峰值归属于![]() 以及
以及![]() 其强度与保留时间随反应时间的延长不断增强,这主要归因于碱液对SO2等酸性气体强大的吸收能力,由于
其强度与保留时间随反应时间的延长不断增强,这主要归因于碱液对SO2等酸性气体强大的吸收能力,由于![]() 离子浓度不断增强,使
离子浓度不断增强,使![]() 和
和![]() 在色谱图中无法很好分离;与图8产生明显差别的是在5.01 min处
在色谱图中无法很好分离;与图8产生明显差别的是在5.01 min处![]() 随反应时间不断减弱,并在30 min后几乎消失,这表明在
随反应时间不断减弱,并在30 min后几乎消失,这表明在![]() 存在的吸收液中存在以下反应。
存在的吸收液中存在以下反应。

图9 添加2.5 mL/min SO2后吸收碱液中不同组分阴离子随测试时间的变化
Fig.9 Evolution of different component anions in the alkaline absorption solution with the addition of 2.5 mL/min SO2 over time

(13)
在此反应中,![]() 和
和![]() 被消耗,生成了更稳定的
被消耗,生成了更稳定的![]() 和
和![]() 因此,可断定S物种的存在促进了亚硝酸盐物种进一步转化,使反应体系更稳定。
因此,可断定S物种的存在促进了亚硝酸盐物种进一步转化,使反应体系更稳定。
3.3 添加Na2SO3碱液中离子性质的变化
第3.2节中在溶液加入SO2使![]() 更好转化为
更好转化为![]() 反应体系更稳定。为证明加入的SO2在碱液中产生的
反应体系更稳定。为证明加入的SO2在碱液中产生的![]() 在吸收液中起到离子催化作用,通过向吸收液中添加0.001 mol/L的Na2SO3深入探究了各离子强度变化,由于吸收液中
在吸收液中起到离子催化作用,通过向吸收液中添加0.001 mol/L的Na2SO3深入探究了各离子强度变化,由于吸收液中![]() 浓度基本恒定,导致
浓度基本恒定,导致![]() 与
与![]() 产生明显分离。其中,13.4 min处归属于
产生明显分离。其中,13.4 min处归属于![]() 的峰值随测试时间有所增强,而10.8 min处
的峰值随测试时间有所增强,而10.8 min处![]() 减弱,这与添加SO2所得到结果相似。如第3.2节所述,
减弱,这与添加SO2所得到结果相似。如第3.2节所述,![]() 离子的促进作用进一步被证实。需要注意的是,这种现象在Na、K混合吸收液中尤为强烈,如图10(c)、10(d)反应30 min后,所测的色谱图中几乎检测不到
离子的促进作用进一步被证实。需要注意的是,这种现象在Na、K混合吸收液中尤为强烈,如图10(c)、10(d)反应30 min后,所测的色谱图中几乎检测不到![]() 这表明Na、K离子的存在促进了该离子反应正向进行。
这表明Na、K离子的存在促进了该离子反应正向进行。

图10 添加0.001 mol/L Na2SO3后吸收碱液中不同组分阴离子随测试时间的变化
Fig.10 Evolution of different component anions in the alkaline absorption solution with the addition of 0.001 mol/L Na2SO3 over time
3.4 吸收液脱硝反应机理探究及反应热计算
为深入探究Na、K离子以及亚硫酸根对硝酸盐的影响,利用密度泛函理论(DFT)模拟计算了 与不同碱金属离子的相互作用,所有计算均使用GaussView 6.0和Gaussian 16软件包进行。在结构中加入氢原子,然后通过半经验量子力学PM6和PM7方法充分优化。极化连续介质模型(PCM)用于模拟水作为溶剂的溶剂化效应[33-34]。
与不同碱金属离子的相互作用,所有计算均使用GaussView 6.0和Gaussian 16软件包进行。在结构中加入氢原子,然后通过半经验量子力学PM6和PM7方法充分优化。极化连续介质模型(PCM)用于模拟水作为溶剂的溶剂化效应[33-34]。
分子构型计算如图11所示。

图11 分子构型计算
Fig.11 Molecular configuration calculation diagram
首先,计算了NO2溶于不同碱液所构建体系热量的变化,如图12所示。由图12(a)可知,由于反应放热使反应体系趋于稳定[35],表明在不同碱液中反应均自发进行,与之产生明显差别的是,构建的反应模型中,吸收液为KOH的体系反应中存在更稳定反应构型,与之前的测试相印证。主要是由于K 离子半径大于Na 离子,在溶液中易形成游离态的OH-,而NO2溶于碱性溶液发生歧化反应,生成亚硝酸与硝酸,由于OH-更易解离,导致所产生的硝酸物种中H 更易释放成为游离态,进一步与碱液中OH-反应生成H2O,促进了反应正向进行。如前所述,当K 浓度过高时,由于液膜限制,并不会有效提高NO吸收率。

图12 反应过程中能量变化
Fig.12 Comparison of energy changes during the reaction process
![]() 对NO吸收率的影响如图12(b)所示,引入亚硫酸根,生成稳定构型后反应焓明显高于单纯的碱液吸收,这可以解释为当吸收液仅为碱液时,NO2在碱液中发生歧化反应,即使是更易解离的KOH溶液,其反应也存在一定饱和值,当引入
对NO吸收率的影响如图12(b)所示,引入亚硫酸根,生成稳定构型后反应焓明显高于单纯的碱液吸收,这可以解释为当吸收液仅为碱液时,NO2在碱液中发生歧化反应,即使是更易解离的KOH溶液,其反应也存在一定饱和值,当引入![]() 物种时,NO2反应增加了新的反应机制,即
物种时,NO2反应增加了新的反应机制,即

(14)
由于SO2在碱液中的溶解度比NO2高1个数级,使影响非常显著,NO2被新的氧化还原途径大量吸收转化,由此增加SO2和NO2气体与吸收液之间的化学反应环节,即增加反应级数可以强化脱硫脱硝效果。
最后,比较混合碱液与单一KOH吸收液反应中的能量变化,探究双金属离子(Na和K)共同催化作用下对促进的SO2和NOx协同湿法脱除的作用机制。在Na-K协同作用下反应模拟计算的分子构型(图11)中,双金属离子的协同作用加快了溶液中亚硫酸根离子以及水分子中H—O键的断裂,促进亚硝酸根的转化形成,H 游离在溶液中。由图12(c)可知,当吸收液仅为KOH时,NO2与SO2协同反应放出热量为243.5 kJ/moL,而将吸收液体系改变为同浓度的混合吸收液时,反应热为299.6 kJ/moL。混合碱液更有利于反应进行,可促进S-N物种的吸收与转化,这可能是双膜效应导致,即气相中的反应物NO2、SO2等由气相主体通过气膜扩散到气相与碱液相邻界面中,并由气相中的反应物由气液相界面扩散到液膜内,在液膜内与由液相主体扩散到液膜内的液相中的反应物进行化学反应。同时气相中的反应物继续向液相主体中扩散,在液膜中未反应的气相反应物进入到液相主体,并与液相主体中的反应物继续反应。而过高浓度的K离子可能抑制了两膜之间的扩散,从而抑制了反应物中间体之间的接触反应。当溶液中为Na、K溶液时,由于双金属离子的电荷传递效应,使气相反应物向液相传递时气膜迅速破裂,减少了气液两相的扩散时间,从而提高了反应效率,如前所述,SO2的加入增加了NO2氧化还原新途径,这使在Na、K离子驱动下,通过SO2的作用,表现出较高的转化率。
通过DFT计算可知,NO2更易在K离子的碱性溶液发生歧化反应生成亚硝酸与硝酸,引入![]() 后反应焓变明显提高,NO2产生了新的反应机制,促进了NO2吸收,K离子浓度过高会抑制气相反应物的扩散,Na、K双金属离子之间的电荷传递会驱动NO2更快吸收转化。
后反应焓变明显提高,NO2产生了新的反应机制,促进了NO2吸收,K离子浓度过高会抑制气相反应物的扩散,Na、K双金属离子之间的电荷传递会驱动NO2更快吸收转化。
4 结 论
1)在单纯测试NO吸收率时,吸收剂为氢氧化钾碱液的组分性能明显高于氢氧化钠,归因于K离子存在更大的离子半径,更易解离OH-所致。
2)通过向气体成分中添加SO2以及在吸收液中添加亚硫酸钠时发现,吸收液中存在![]() 离子进一步促进了硝酸盐物种的吸收转化,这是由于引入了新的氧化还原反应所导致,而双组分吸收液(Na、K)效率更高,是由于双金属离子的电荷传递效应,使气相反应物向液相传递时气膜迅速破裂,减少了气液两相的扩散时间,从而提高了反应效率。
离子进一步促进了硝酸盐物种的吸收转化,这是由于引入了新的氧化还原反应所导致,而双组分吸收液(Na、K)效率更高,是由于双金属离子的电荷传递效应,使气相反应物向液相传递时气膜迅速破裂,减少了气液两相的扩散时间,从而提高了反应效率。
3)利用DFT计算充分证实了这一点。在![]() 的驱动下,通过Na、K离子的协同作用,NO脱除效果更好。
的驱动下,通过Na、K离子的协同作用,NO脱除效果更好。
[1] NI S, TANG X, YI H, et al. Novel Mn-Ce bi-oxides loaded on 3D monolithic nickel foam for low-temperature NH3-SCR de-NO : Preparation optimization and reaction mechanism[J].Journal of Rare Earths, 2022,40(2):268-278.
[2] SHI X, GUO J, SHEN T, et al. Enhancement of Ce doped La-Mn oxides for the selective catalytic reduction of NOx with NH3 and SO2 and/or H2O resistance[J]. Chemical Engineering Journal, 2021,421:129995.
[3] 张银玲, 王中合, 郗云鸿, 等. 湿法脱硝治理氮氧化物的研究现状[J]. 材料开发与应用, 2014,29(3):94-98.
ZHANG Yinling,WANG Hezhong,XI Yunhong,et al. Research status of wet denitrification treatment of nitrogen oxides[J].Development and Application of Materials, 2014,29(3):94-98.
[4] CHEN C, XIE H, HE P, et al. Comparison of low-temperature catalytic activity and H2O/SO2 resistance of the Ce-Mn/TiO2 NH3-SCR catalysts prepared by the reverse co-precipitation, co-precipitation and impregnation method[J]. Applied Surface Sciencei, 2022,571:151285.
[5] 侯丽敏,栗浩博,乔超越,等.锰修饰稀土尾矿催化剂NH3-SCR性能研究[J].中国稀土学报,2023,41(2):287-295.
HOU Limin,JIA Haobo,QIAO Yuechao,et al. Performance of rare earth tailings catalyst modified by manganese for NH3-SCR[J].Journal of the Chinese Society of Rare Earths,2023,41(2):287-295.
[6] FANG P, CEN C, WANG X, et al. Simultaneous removal of SO2, NO and Hg0 by wet scrubbing using urea KMnO4 solution[J]. Fuel Processing Technology, 2013,106:645-653.
[7] YANG Y, ZHENG C, Su Q, et al. SOx removal and emission characteristics of WFGD system applied in ultra-low emission coal-fired power plants[J].Case Studies in Thermal Engineering, 2021,28:101562.
[8] 贠宏飞. 碱性废水脱硫脱硝一体化技术研究[D]. 兰州:兰州理工大学, 2014.
[9] 钟晓伟, 张旭斌, 蔡旺锋, 等. 臭氧氧化结合氨法同时脱硫脱硝的实验研究[J]. 化学工程, 2017,45(7):7-11.
ZHONG Xiaowei, ZHANG Xubin, CAI Wangfeng, et al. Experimental study on simultaneous desulfurization and denitrification by ozone oxidation combined with ammonia [J].Chemical Engineering, 2017,45(7):7-11.
[10] ZHANG W, CHEN J, GUO L, et al. Research progress on NH3-SCR mechanism of metal-supported zeolite catalysts[J]. Journal of Fuel Chemistry and Technology, 2021,49(9):1294-1315.
[11] LIU J, LI X, LI R, et al. Facile synthesis of tube-shaped Mn-Ni-Ti solid solution and preferable Langmuir-Hinshelwood mechanism for selective catalytic reduction of NO by NH3[J]. Applied Catalysis A: General, 2018,549:289-301.
[12] LI G, WANG B, XU W Q, et al. Simultaneous removal of SO2 and NOx from flue gas by wet scrubbing using a urea solution[J]. Environment Technology, 2019,40(20):2620-2632.
[13] 祝贺, 陈悦. 燃煤工业炉烟气湿法脱硫脱销技术研究[J]. 山东工业技术, 2015(22):34.
ZHU He, CHEN Yue. Research on wet desulphurization and desorption of flue gas from coal-fired industrial furnace[J]. Shandong Industrial Technology, 2015(22):34.
[14] TIAN S, YANG S, WANG J, et al. Integrated strategy for efficient simultaneous desulfurization and denitrification of flue gas and high value conversion of sulfur and nitrogen resources[J]. Journal of Hazardous Materials, 2022,440:129827.
[15] LI Y, CHE D, YANG C, et al. Engineering practice and economic analysis of ozone oxidation wet denitrification technology[J]. Chinese Journal of Chemical Engineering, 2021,29:401-408.
[16] LI D, WEI Z, LI S, et al. Performance and operational strategy of simultaneous nitrification, denitrification, and phosphorus removal system under the condition of low organic loading rate in wet weather[J]. Chemosphere, 2021,270:129464.
[17] CHU H, CHIEN T W, LI S Y. Simultaneous absorption of SO2 and NO from flue gas with KMnO4/NaOH solutions[J]. Science of the Total Environment, 2001,275(1):127-135.
[18] SHAO J, MA Q, WANG Z, et al. A superior liquid phase cata-lyst for enhanced absorption of NO2 together with SO2 after low temperature ozone oxidation for flue gas treatment[J]. Fuel,2019,247:1-9.
[19] MONDAL M K, CHELLUBOYANA V R. New experimental res-ults of combined SO2 and NO removal from simulated gas stream by NaClO as low-cost absorbent[J]. Chemical Engineering Journal, 2013,217:48-53.
[20] LIU Z, XU H, LI Y, et al. NOx removal from gas mixture intensified by rotating packed bed with NaClO2 preoxidation[J]. Chemical Engineering Journal, 2022,430:132671.
[21] 任俊鹏. 添加剂在湿法烟气脱硝技术中的应用研究[D]. 北京:北京化工大学, 2019.
[22] 杨加强, 梅毅, 王驰, 等. 湿法烟气脱硝技术现状及发展[J]. 化工进展, 2017,36(2):695-704.
YANG Jiaqiang, MEI Yi, WANG Chi,et al. Current situation and development of wet flue gas denitrification technology[J].Chemical Industry and Engineering Progress, 2017,36(2):695-704.
[23] FANG P, CEN C, WANG X, et al. Simultaneous removal of SO2, NO and Hg0 by wet scrubbing using urea KMnO4 solution[J]. Fuel Process Technology, 2013,106:645-653.
[24] NI P, WANG X, LI H. A review on regulations, current status, effects and reduction strategies of emissions for marine diesel engines[J]. Fuel, 2020,279:118477.
[25] LI B, LIU Y, ZHAO X, et al. O3 oxidation excited by yellow phosphorus emulsion coupling with red mud absorption for denitration[J]. Journal of Hazardous Materials, 2021,403:123971.
[26] 任晓莉, 张雪梅, 张卫江, 等. 碱液吸收法治理含NOx工艺尾气实验研究[J]. 化学工程, 2006(9):63-66.
REN Xiaoli, ZHANG Xuemei, ZHANG Weijiang,et al. Experimental study on the treatment of NOx - containing exhaust gas by lye absorption [J].Chemical Engineering, 2006(9):63-66.
[27] NI P, WANG X, LI H. A review on regulations, current status, effects and reduction strategies of emissions for marine diesel engines[J]. Fuel , 2020,279:118477.
[28] CHU H, CHIEN T, TWU B. The absorption kinetics of NO in NaClO2/NaOH solutions[J]. Journal of Hazardous Materials, 2001,84(2/3):241-252.
[29] LIU J, WANG Z, LI G, et al. Recognition of the effect of O2 on the complexation absorption of NO in the FeII/Na2SO3 system[J]. Process Safety and Environmental Protection, 2022,161:651-657.
[30] SHI F, LI K, LI J, et al. Simultaneous wet absorption of SO2 and NOx with mixed Na2SO3 and (NH4)2SO3: Effects of mass concentration ratio and pH[J]. Chemical Engineering Journal, 2021,421:129945.
[31] LI S, HUANG W, XU H, et al. Enhanced simultaneous absorption of NOx and SO2 in oxidation-reduction-absorption process with a compounded system based on Na2SO3[J]. Journal of Environmental Sciences, 2022,111:1-10.
[32] LIU S, LIAN Z, ZHANG M, et al. Intensification of NO2 remo-val in sulfite solutions with reusable copper chloride: Mechanism and process parameters[J]. Separation and Purification Technology, 2023,308:122996.
[33] BARONE V,COSSI M,TOMASI J.A new definition of cavities for the computation of solution free energies by the polarizale continuum mode[J]. Journal of Chemical Physics,1997,107(8): 3210-3221.
[34] GAO Y, LIU Z, GAO Y, et al. Employing the double-PCM (Phase-Change Material) layer to improve the seasonal adaption of building walls: A comparative studies[J]. Journal of Energy Storage, 2023,66:107404.
[35] 马嘉慧. 基于化学反应热测试对吸收CO2胺液配方的筛选研究[D]. 青岛:中国石油大学(华东), 2017.
Influence mechanism of Na-K synergism on the evolution of NOx in wet NO reduction

SHAO Ranlei,HAN Shiwang,XUAN Chengbo,et al.Influence mechanism of Na-K synergism on the evolution of NOx in wet NO reduction[J].Clean Coal Technology,2023,29(10):166-175.

 ions further promote the absorption and conversion of nitrate species.
ions further promote the absorption and conversion of nitrate species.