CO2加氢制甲醇反应动力学及工艺能耗优化
0 引 言
随着人口增长和社会生产力发展,人类对能源需求与日俱增。依据《bp世界能源统计年鉴-2022》[1],排除2020年疫情影响,2011到2021年世界一次能源消费量呈上升趋势,年均增长率达1.3%。由此带来的全球气候变暖已成为威胁人类及其他生物生存的重要问题[2-4]。为应对上述危机,各国提出碳中和目标。碳捕集、利用和封存(CCUS)技术被认为是实现碳中和最有前景的方法之一[5-9]。相比于CO2捕集并封存技术(CCS),通过热[10-11]、电[12-14]、光[15-16]催化过程利用捕集CO2的CCU技术目前被认为应用前景更好。甲醇作为重要化工原料,亦是石油替代燃料,经济价值和市场空间大。依国际可再生能源署统计,目前绝大部分甲醇均由传统化石燃料生产,预计到2050年由于甲醇生产会导致每年1.5 Gt CO2排放[17]。2005年,诺奖得主OLAH提出甲醇经济概念[18],希望通过可再生能源制氢与二氧化碳加氢技术耦合实现脱离化石燃料。故将清洁能源生产的氢气用于CO2还原生产甲醇,既减少甲醇生产碳排放,亦可实现可再生能源化学储存,是实现CO2资源化利用的有效手段之一。
目前甲醇产品主要通过合成气法生产。对于化工生产,开发二氧化碳制甲醇新工艺、设计新型反应器或优化工艺,都依赖建立反应动力学方程。因目前该反应在催化机理方面仍不明确,且催化剂类型多样,不同研究者在不同催化剂体系基础上已建立多种反应动力学模型。目前已有动力学模型包括基于详细反应机理的机理动力学模型[19-20]、幂律模型[21]和微动力学模型[22]。每种模型因假设不同,结果差距较大,针对不同催化剂体系无普适性。如LEDAKOWICZ等[23]用幂律模型构建针对4种催化剂的动力学方程,发现该模型对不同催化剂体系间相对误差最大达25%。此外,实现二氧化碳加氢制甲醇工艺大规模应用,需优化整个过程能耗,但目前相关研究较少。笔者通过测试不同温度、压力及氢碳比下商用Cu-ZnO/Al2O3(物质的量比60%、25%、15%)催化剂催化性能,用LHHW模型拟合得到本体系中CO2加氢制甲醇反应动力学方程。将上述动力学试验结果代入Aspen Plus产率反应器模型,构建CO2加氢制甲醇循环工艺,模拟优化整个工艺能耗。结合实际催化剂反应活性结果与模拟过程,得到较为合理的能耗优化结果,为后续工程设计提供参考。
1 试 验
1.1 试验试剂与仪器
试验催化剂采用商用Cu-ZnO/Al2O3催化剂(蜀泰化工)。试验仪器包括气固相多通道反应装置(GDC-1型,海安石油科研仪器有限公司)、质量流量计(D08-8C,北京七星华创流量计有限公司)、气相色谱(GC-7820,山东惠分仪器有限公司)。
1.2 催化活性评价方法
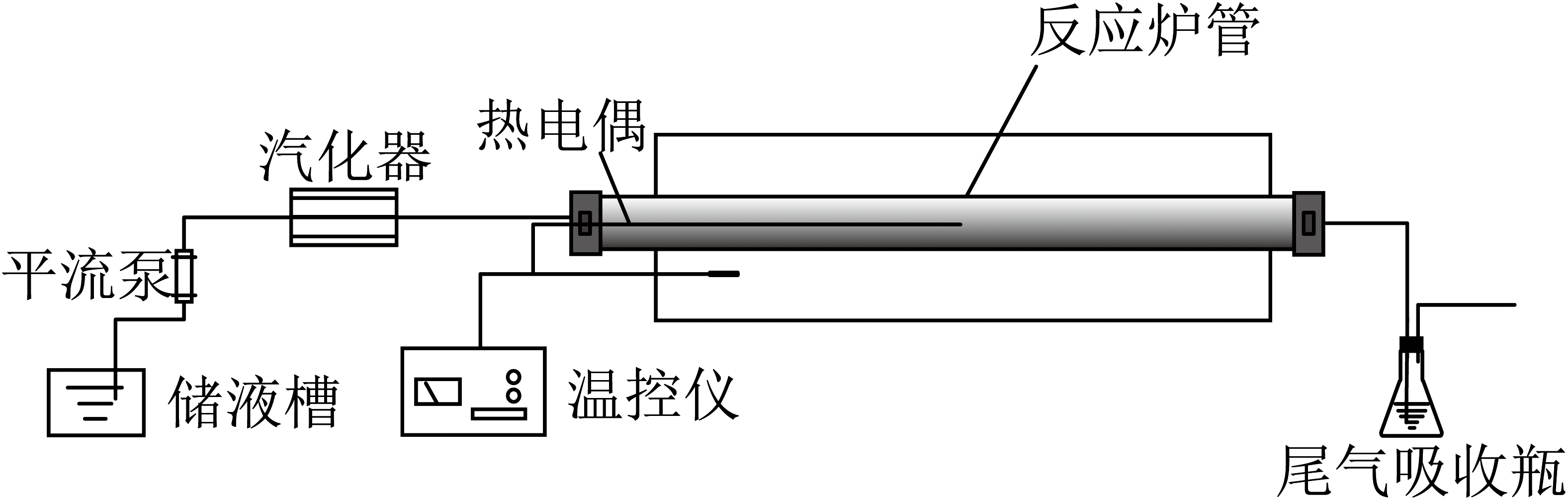
催化剂测试在等温固定床反应器(内径8 mm 、长500 mm)中进行。称取0.5 g催化剂用于反应,通过上下2层石英棉将催化剂固定在反应器中合适位置。用镍铬-康铜热电偶测量催化剂床层温度(精度± 0.1 K),通过反应器出口处的背压阀控制反应器内压力,用精密压力表监测反应器内压力(精度±0.01 MPa)。测试过程如下:
1)催化剂还原:常压下向反应器中通入85% H2(其余为N2),流量30 mL/min,以2 K/min升温速率升至573.15 K还原2 h,并在相同气氛下冷却至室温。
2)活性测试:反应原料气用CO2、H2和N2混合气,N2作为内标气用于反应产物定量分析。H2、N2的混合气(体积分数85%/15%)与CO2分别经质量流量计控制流量后进入反应器,气体总流量控制在120 mL/min,CO2 、H2物质的量比1 : 3。调节反应器出口处背压阀使反应器内压力升至3 MPa,以5 K/min速率升温至513.15 K反应。
3)产物检测:反应后出口气体保温383.15 K,经背压阀减压后直接进入配备FID和TCD检测器的气相色谱中在线检测。FID检测器连接plot-Q毛细管柱,检测甲醇、甲烷、二甲醚等可能产物,TCD检测器连接5A分子筛柱和TDX-01柱,分别用于检测氮气、氢气、一氧化碳和二氧化碳。
4)产物分析:主要考察CO2转化率x、甲醇选择性S及和时空收率STY。计算方法如下[24]:

(1)

(2)

(3)
式中,n为CO2、CH3OH、CO摩尔流量(mol/min),通过内标法计算得到;下标in、out为反应器进出口,product为CO或CH3OH;GHSV为空速,L/(g·h);Y为摩尔分数;M为甲醇摩尔质量,g/mol;22.4为标准大气压下气体摩尔体积,mL/mmol。
2 结果与讨论
2.1 本征动力学研究
2.1.1 内、外扩散消除试验
气固相催化反应包括7个步骤,按气体转移路径可分为内、外扩散和表面反应3步骤,前二者主要受传质过程影响,对催化剂进行本征动力学研究时,需提高反应空速及降低催化剂粒径,分别消除外扩散和内扩散对反应的影响。AN等[25]等指出,对Cu/Zn/Al/Zr催化剂,空速达0.9 L/(g·h)时可消除外扩散影响,催化剂粒径小于0.35 mm时可消除内扩散影响。
笔者在513.15 K、3 MPa、空速14 L/(g·h)测试400~800、200~400和160~200 μm 3种不同粒径催化剂,得到粒径对反应转化率影响。试验结果见表1。发现催化剂粒径小于200 μm时,CO2转化率增幅仅0.13%,因此认为已基本消除内扩散影响。故后续CO2加氢试验中均用200~400 μm催化剂测试。
表1 催化剂粒径对CO2转化率影响
Table 1 Effect of catalyst particle size on CO2 conversion

为消除外扩散对反应影响,在上述相同温度和压力下,测试在空速9~19 L/(g·h)催化剂反应性能,得到空速对CO2转化率影响。结果见表2。可知随空速增加,反应物停留时间缩短,CO2转化率随之降低。当空速从9 L/(g·h)升至14 L/(g·h)时,CO2转化率大幅下降,而空速大于14 L/(g·h)时,CO2转化率下降幅度明显减小,仅0.44%,故认为此时外扩散影响已基本消除。
表2 空速对CO2转化率影响
Table 2 Effect of space velocity on CO2 conversion

为进一步探明催化剂性能,测试不同条件催化性能。用200~400 μm催化剂,空速14 L/(g·h),测定不同温度(448.15~543.15 K),压力(1~3 MPa)及H2 、CO2物质的量比(3~9)的反应性能,得到21组数据,结果见表3。所有数据均由气相色谱多次采样结果计算平均值得到。
表3 催化剂测试结果
Table 3 Experimental data of CO2 hydrogenation to methanol

续表

根据试验结果发现,由于CO2分子惰性,CO2活化困难。因此,随着反应温度升高CO2转化率逐渐增大。但从反应热力学角度,生成甲醇的反应均放热,而生成CO的逆水气变换吸热,升温利于该反应进行,导致甲醇选择性降低。甲醇选择性也受H2、CO2物质的量比影响,随物质的量比增大,甲醇选择性上升。
2.1.2 动力学模型构建
CO2加氢制甲醇主要为如下3个反应方程:
CO2 3H2 ![]() CH3OH H2O,
CH3OH H2O,
(4)
CO2 H2![]() CO H2O,
CO H2O,
(5)
CO 2H2 ![]() CH3OH。
CH3OH。
(6)
式(4)、(5)、(6)的反应热ΔH分别为-49.5、41.2和-90.8 kJ/mol。如式(4)~式(6)所示,CO2加氢生成甲醇过程分子数减少。因此增大反应压力有助于反应正向进行,提高CO2转化率和甲醇选择性。
CO2加氢制甲醇机理及甲醇碳源目前尚存争论。KUNKES等[26]通过在Cu/ZnO/Al2O3催化剂上进行H/D取代试验,确认式(4)和(5)无相同中间产物,说明CO2加氢过程中甲醇生成不通过连续逆水煤气反应和CO加氢步骤,CO2是甲醇产生的直接碳源。此外,LIU等[27]通过密度泛函理论(DFT)和动力学蒙特卡罗方法(KMC)模拟铜基催化剂上二氧化碳加氢,发现当催化剂表面主要为铜原子时,CO2为甲醇产生的主要碳源,此时反应路径为甲酸根(HCOO*)途径,速率控制步骤为HCOOH*→H2COOH*。而逆水煤气反应路径为羧酸根(COOH*)途径,速率控制步骤为CO2→tran-COOH*。也有研究者指出CO由铜表面吸附的CO2直接解离产生[28]。笔者采用甲酸根途径生成甲醇和CO的观点,以式(4)、(5)的反应为独立反应,推导反应速率方程如式(7)、(8)所示。

(7)

(8)
其中,r、k的下标1,2分别代表式(4)、(5)的反应;r为反应速率,g/(g·h);k为反应速率常数;f为组分逸度,MPa;K为吸附常数;K(f)为以逸度表示的反应平衡常数。k与K的表达式如下:

(9)

(10)
其中,i代表式(4)、(5)的反应;j为CO2或H2;k0i为频率因子;Ei为反应活化能,kJ/mol;R为理想气体常数,J/(mol·K);T为温度,K;aj、bj为方程系数;![]() 为所有测试的平均温度,K。逸度系数可用SHBWR状态方程计算[29]。以CO2为例,其逸度系数φ计算方程如式(11)所示。Kf计算方法如式(12)、(13)所示[30]。
为所有测试的平均温度,K。逸度系数可用SHBWR状态方程计算[29]。以CO2为例,其逸度系数φ计算方程如式(11)所示。Kf计算方法如式(12)、(13)所示[30]。

(11)

(12)

(13)
式中,P为压力,MPa;y为摩尔分数;Kf的下标1、2分别代表式(4)、(5)的反应。
2.1.3 参数求解
笔者利用遗传算法求解上述动力学方程参数。以反应速率r的计算值与试验值残差平方和为目标函数。最后在MATLAB中建立模型优化函数,具体如下:
S=∑(ri,c-ri,e)2,
(14)
式中,S为计算值与试验值的残差平方和;下标i表示反应式(4)、(5);c、e分别表示计算值和试验值。将试验数据带入动力学方程,在MATLAB中求解得到结果如下:

(15)

(16)

(17)

(18)
式中,k的下标1、2分别代表式(4)、(5)的反应。
2.1.4 参数检验
将上述参数和试验数据代入式(7)、(8),得到r2=0.994,参数回归结果与试验结果相符。此外,模型中所求参数有其对应物理化学意义,应从此方向对所求参数进一步检验,标准包括:① 反应活化能Ei>0,文献[31]指出式(4)反应活化能33~75 kJ/mol,式(5)反应活化能84~125 kJ/mol;② 频率因子k0i>0;③ 吸附常数bi<0。依上述模型参数检验标准,笔者所求参数均在合理范围内。
2.2 Aspen模拟与能量优化
2.2.1 Aspen模拟工艺建立
在Aspen Plus V9中构建气体循环制甲醇工艺流程(图1),物性方法选用NRTL。进口物料原料气为高压CO2和H2流。主要操作单元有转化率反应器R1,多级压缩机P1,精馏塔T1、T2,吸收塔ABSORB,换热器E1、E2等。

图1 二氧化碳加氢制甲醇循环工艺流程
Fig.1 Process flow of CO2 hydrogenation to methanol
2.2.2 物料衡算结果
如图1所示工艺流程中,原料气FEED(CO2、H2、CO物质的量比23∶75∶2)和循环回收气体经混合器MIX1混合后进入换热器E1中,升温至513.15 K后进入反应器R1中反应,依试验数据分别设定3个反应的转化率。反应器出口物料经换热器E2冷却至333.15 K后进入闪蒸器FLASH中气液相分离。分离后气相流股进入吸收塔ABSORB,以水为吸收剂,将甲醇吸收到液相中与闪蒸器FLASH出口液相流股混合后进入精馏塔T1和T2进行甲醇精制。大部分CO2、H2和CO从吸收塔ABSORB顶部排出,进入循环过程。在精馏段,T1塔使用加压精馏,压力设定2 MPa用于分离液相中残存的少量CO2、H2和CO,从塔顶采出后与吸收塔塔顶流股混合进入循环。分流器SPLIT分流分率0.95,剩余5%气体作为驰放气排出。T2塔使用常压精馏,用于分离甲醇和水,甲醇从塔顶采出。最终所得产品为纯度>99.5%精甲醇,回收率>99%。整个过程物料衡算结果见表4。各主要操作单元能耗见表5。由此计算得甲醇生产能耗8.41 GJ/t。
表4 物料衡算结果
Table 4 Material balance result

表5 各主要操作单元能耗
Table 5 Energy consumption of each main operating unit

2.2.3 工艺能耗优化
依据以上结果,换热器E1占整体能耗比例大。因此考虑对反应器出口物料进行热量回收,构建如图2所示工艺流程。通过增加管壳式换热器E3,将反应器出口物流用于对原料气与循环物流的预加热。通过换热器E3将原进料流股混合料加热至493.15 K,再进入E1中继续加热至反应温度。反应器出口物流也由513.15 K降至389.15 K,随后进入换热器E2进一步冷却。换热器E3换热面积7.34 m2,极大降低换热器E1、E2热负荷。计算得到此时甲醇生产能耗降为5.53 GJ/t,各操作单元能耗见表6。

图2 反应器出口热量回收工艺流程
Fig.2 Process flow of reactor outlet heat recovery
表6 反应器出口热量回收工艺各主要操作单元能耗
Table 6 Energy consumption of each main operating unit of the reactor outlet heat recovery process

2.2.4 闪蒸分离温度对工艺流程影响
如图2所示工艺流程中,对换热器E2冷却温度进行灵敏度分析,设定温度293.15~333.15 K,探究闪蒸温度对吸收塔所需水量及精馏塔T1、T2再沸器负荷的影响。模拟结果如图3所示。可知随闪蒸温度降低,更多甲醇进入液相流股,进入吸收塔中甲醇量减少,使吸收塔所需水量下降,利于后续甲醇与水的分离。如图3(b)所示,随闪蒸温度降低,精馏塔T1、T2热负荷均降低,且降幅随温度减小而下降。闪蒸温度选择323.15 K较适宜。此时甲醇生产能耗4.84 GJ/t。

图3 闪蒸温度对工艺流程的影响
Fig.3 Effect of flash temperature on process
2.2.5 换热器E3换热温度对工艺流程影响
在323.15 K闪蒸温度,保持进料及其他模块工艺参数不变,对换热器E3出口冷流股温度进行灵敏度分析。设定出口冷流股温度473.15~503.15 K,探究换热器E3出口冷流股温度对换热器E3换热面积及换热器E1能耗的影响。模拟结果如图4所示。随冷流股升温,换热器E3面积增大,且增量递增。而E1能耗随冷流股出口温度上升而线性下降。考虑到设备费和能耗综合影响,冷流股温度应设定在498.15 K以下。

图4 换热器E3换热温度对工艺流程的影响
Fig.4 Effect of heat exchanger E3 heat transfer temperature on the process
2.2.6 分流分率对工艺流程影响
如图2所示工艺流程中,改变分离器SPLIT单元的分流分率,探究不同分流分率下工艺能耗变化如图5所示。随分流分率从0.95升至0.99,多级压缩机P1能耗逐渐升高,且速率逐渐增大。换热器E1能耗也保持相同变化规律。2精馏塔能耗略提升。单位时间甲醇产量略提升。整体甲醇生产能耗随分流分率提高逐渐增大。

图5 分流分率对工艺能耗影响
Fig.5 Effect of shunt fraction on process energy consumption
3 结 论
1)对商用Cu-ZnO/Al2O3催化剂用于CO2加氢的催化活性进行了测试。由于CO2分子的惰性,CO2活化较难,因此催化剂活性受温度影响显著:随反应温度升高CO2转化率增大。但从反应热力学角度,生成甲醇的反应均放热,而生成CO的逆水气变换反应吸热,升温利于该反应进行,导致甲醇选择性降低。甲醇选择性同时也受H2、CO2物质的量比影响,随着物质的量比增大,甲醇选择性上升。由于反应后分子数减少,增大压力利于催化剂活性提升。
2)以甲酸盐加氢步骤为反应的速率控制步骤,建立动力学方程模型,依试验数据和动力学模型,通过MATLAB求解得该催化剂在CO2加氢制甲醇中动力学模型参数,可为实际生产提供指导。
3)在CO2加氢制甲醇循环工艺中,主要能耗集中于精馏与循环物流加热。通过增加管壳式换热器回收反应器出口物流热量,可大幅降低加热能耗。降低闪蒸温度可大幅降低吸收塔所需吸收水量,降低后续水-甲醇分离能耗,使精馏塔T2再沸器负荷降低。闪蒸温度323.15 K时,整个工艺达到达最优,此时甲醇生产能耗4.84 GJ/t。此外,分流分率对压缩机能耗影响显著,整个工艺能耗随分流分率的提高而增加。
[1] 英国石油公司.bp世界能源统计年鉴-2022[EB/OL]. (2022-06-28)[2024-01-20]. https://www.bp.com.cn/zh_cn/china/home/news/reports.html.
[2] LIANG B, MA J, SU X, et al. Investigation on deactivation of Cu/ZnO/Al2O3 catalyst for CO2 hydrogenation to methanol[J]. Industrial &Engineering Chemistry Research, 2019, 58(21): 9030-9037.
[3] MONCADA J, CHEN X, DENG K, et al. Structural and chemical evolution of an inverse CeOx/Cu catalyst under CO2 hydrogenation: Tunning oxide morphology to improve activity and selectivity [J]. ACS Catalysis, 2023: 15248-15258.
[4] TANG C, TANG S, SHA F, et al. Insights into the selectivity determinant and rate-determining step of CO2 hydrogenation to methanol[J]. The Journal of Physical Chemistry C, 2022, 126(25): 10399-10407.
[5] CHEN S, LIU J, ZHANG Q, et al. A critical review on depl-oyment planning and risk analysis of carbon capture, utilization, and storage (CCUS) toward carbon neutrality [J]. Renewable and Sustainable Energy Reviews, 2022, 167: 112537.
[6] VARGAS G E L, SANT'ANNA L G. Integrated assessment of global carbon capture, utilization, and storage projects [J]. International Journal of Greenhouse Gas Control, 2024, 131: 104031.
[7] SIMONSEN K R, HANSEN D S, PEDERSEN S. Challenges in CO2 transportation: Trends and perspectives [J]. Renewable and Sustainable Energy Reviews, 2024, 191: 114149.
[8] LAMBERTS V A H, LAVRUTICH M, Compernolle T, et al. CO2 storage or utilization? A real options analysis under market and technological uncertainty [J]. Journal of Environmental Economics and Management, 2023, 122: 102902.
[9] WANG P, SHI B, LI N, et al. CCUS development in China and forecast its contribution to emission reduction[J]. Scientific Reports, 2023, 13(1): 17811.
[10] LARMIER K, LIAO W C, TADA S, et al. CO2-to-methanol hydrogenation on zirconia-supported copper nanoparticles: Reaction intermediates and the role of the metal-support interface [J]. Angewandte Chemie Intemational Edition, 2017, 56(9): 2318-2323.
[11] WANG J J, LI G N, LI Z L, et al. A highly selective and stable ZnO-ZrO2 solid solution catalyst for CO2 hydrogenation to methanol [J]. Science Advances, 2017, 3(10): e1701290.
[12] LIU S, YANG H, HUANG X, et al. Identifying active sites of nitrogen-doped carbon materials for the CO2 reduction reaction [J]. Advanced Functional Materials, 2018, 28(21): 1-7.
[13] MAO X, HE T, KOUR G, et al. Computational electrocatalysis beyond conventional hydrogen electrode model: CO2 reduction to C2 species on copper facilitated by dynamically formed solvent halide ions at the solid-liquid interface [J]. Chemical Science, 2024, 15(9): 3330-3338.
[14] WANG Y M, YAN F Q, WANG Q Y, et al. Single-atom tailored atomically-precise nanoclusters for enhanced electrochemical reduction of CO2-to-CO activity [J]. Nature Communications, 2024, 15(1): 1843.
[15] KONDRATENKO E V, MUL G, BALTRUSAITIS J, et al. Status and perspectives of CO2 conversion into fuels and chemicals by catalytic, photocatalytic and electrocatalytic processes [J]. Energy &Environmental Science, 2013, 6(11): 3112-3135.
[16] TALBI K, PENAS-HIDALGO F, ROBINSON A L, et al. Photocatalytic CO2 reduction by Ni-substituted polyoxometala-tes: Structure-activity relationships and mechanistic insights [J]. Applied Catalysis B: Environmental, 2024, 345: 123681.
[17] IRENA. Innovation outlook: Renewable methanol[EB/OL]. (2021-01-27)[2024-01-20]. https://www.irena.org/publications/2021/Jan/Innovation-Outlook-Renewable-Methanol.
[18] OLAH G A. Beyond oil and gas: The methanol economy[J]. Angewandte Chemie-International Edition, 2005, 44(18): 2636-2639.
[19] PORTHA J F, PARKHOMENKO K, KOBL K, et al. Kinetics of methanol synthesis from carbon dioxide hydrogenation over copper-zinc oxide catalysts[J]. Industrial &Engineering Chemistry Research, 2017,56(45): 13133-13145.
[20] GRAAF G, STAMHUIS E, BEENACKERS A. Kinetics of low-pressure methanol synthesis[J]. Chemical Engineering Science, 1988, 43(12): 3185-3195.
[21] KOBL K, THOMAS S, ZIMMERMANN Y, et al. Power-law kinetics of methanol synthesis from carbon dioxide and hydrogen on copper-zinc oxide catalysts with alumina or zirconia supports[J]. Catalysis Today, 2016, 270: 31-42.
[22] SNIDER J L, STREIBEL V, HUBERT M A, et al. Revealing the synergy between oxide and alloy phases on the performance of bimetallic in-pd catalysts for CO2 hydrogenation to methanol[J]. ACS Catalysis, 2019,9(4): 3399-3412.
[23] LEDAKOWICZ S, NOWICKI L, PETERA J, et al. Kinetic characterisation of catalysts for methanol synthesis[J]. Chemical and Process Engineering, 2013, 34(4): 497-506.
[24] LEE K, MENDES P C D, JEON H, et al. Engineering nanoscale H supply chain to accelerate methanol synthesis on ZnZrOx[J]. Nature Communications, 2023, 14(1):819.
[25] AN X, ZUO Y Z, ZHANG Q, et al. Methanol synthesis from CO2 hydrogenation with a Cu/Zn/Al/Zr fibrous catalyst[J]. Chinese Journal of Chemical Engineering, 2009, 17(1): 88-94.
[26] KUNKES E L, STUDT F, ABILD-PEDERSEN F, et al. Hydrogenation of CO2 to methanol and CO on Cu/ZnO/Al2O3: Is there a common intermediate or not?[J]. Journal of Catalysis, 2015, 328(SI): 43-48.
[27] LIU Y M, LIU J T, LIU S Z, et al. Reaction mechanisms of methanol synthesis from CO/CO2 hydrogenation on Cu2O(111): Comparison with Cu(111)[J]. Journal of CO2 Utilization, 2017, 20: 59-65.
[28] BUSSCHE V K M, FROMENT G F. A steady-state kinetic model for methanol synthesis and the water gas[J]. Journal of Catalysis, 1996,161(1): 1-10.
[29] 张琦,杨静,应卫勇,等. 合成气合成二甲醚平衡转化率及选择率计算模型[J]. 化学工程, 2005, (2): 64-68.
ZHANG Qi,YANG Jing,YING Weiyong,et al. Calculation of eguilibrium conversion and selectivity for dimethyl ether synthesis from syngas[J]. Chemical Engineering,2005,(2): 64-68
[30] 车轶菲, 李涛, 张海涛. Cu/ZnO/Al2O3改性催化剂上CO2加氢制甲醇的本征动力学[J]. 华东理工大学学报(自然科学版), 2020, 46(3): 326-333.
CHE Yifei, LI Tao, ZHANG Haitao. Intrinsickinetics of hydrogenation of CO2 towards methanol on a Cu/ZnO/Al2O3 modified catalyst[J]. Journal of East China University of Science and Technology, 2020, 46(3): 326-333.
[31] ALEJANDRO K, PATRICIO R. The role of copper particle size in low pressure methanol synthesis via CO2 hydrogenation over Cu/ZnO catalysts[J]. Catalysis Science &Technology, 2015, 5(2): 869-881.
Kinetics and process flow simulation and optimization of CO2 hydrogenation to methanol

移动阅读